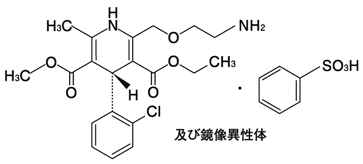
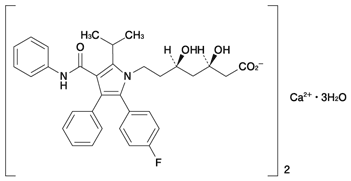
1
堀本政夫ほか:応用薬理. 1991;42(2):167-176
2
Naito T,et al.:J Hum Lact. 2015;31(2):301-306
3
桑島巌ほか:Geriatric Medicine. 1991;29(6):899-902
4
Laine K,et al.:Br J Clin Pharmacol. 1997;43(1):29-33
5
社内資料:健康成人における単回投与時の安全性と薬物動態ならびに食事の影響(承認年月日:2009.7.7、CTD2.7.1.2.2.1、2.7.2.3.2)
6
社内資料:2.5mg/5mgの生物学的同等性(承認年月日:2009.7.7、CTD2.7.1.2.1.3)
7
社内資料:2.5mg/10mgの生物学的同等性(承認年月日:2009.7.7、CTD2.7.1.2.1.4)
8
社内資料:5mg/5mgの生物学的同等性(承認年月日:2009.7.7、CTD2.7.1.2.1.2)
9
社内資料:5mg/10mgの生物学的同等性(承認年月日:2009.7.7、CTD2.7.1.2.1.1)
10
社内資料:アムロジピンとアトルバスタチンとの薬物相互作用(承認年月日:2009.7.7、CTD2.7.2.2.1.1)
11
社内資料:アムロジピンのアトルバスタチンに対する作用(承認年月日:2009.7.7、CTD2.7.2.2.1.2)
12
中島光好ほか:臨床医薬. 1991;7(7):1407-1435
13
大石紫満子ほか:薬理と治療. 1998;26(8):1279-1293
14
根本裕之ほか:薬理と治療. 1998;26(8):1229-1240
15
大石紫満子ほか:薬理と治療. 1998;26(8):1253-1266
16
社内資料:アトルバスタチンのヒトミクロソームにおけるin vitro代謝
17
Beresford AP,et al.:Xenobiotica. 1988;18(2):245-254
18
社内資料:アムロジピンの主要代謝物及び分解物の薬理作用
19
社内資料:14C-アトルバスタチン投与時の尿及び糞中排泄率
20
社内資料:14C-アトルバスタチン投与時の糞中排泄率
21
社内資料:14C-アトルバスタチン投与時の胆汁中排泄率
22
Stern RH,et al.:J Clin Pharmacol. 1997;37(9):816-819
23
足立幸彦ほか:薬理と治療. 1991;19(7):2923-2932
24
社内資料:肝硬変患者におけるアトルバスタチンの薬物動態
25
大石紫満子ほか:薬理と治療. 1998;26(8):1295-1305
26
社内資料:高血圧症及び高脂血症併発患者に対するアムロジピンとアトルバスタチン併用の臨床効果(承認年月日:2009.7.7、CTD2.7.3.2.2
27
増山善明ほか:薬理と治療. 1991;19(7):2853-2871
28
増山善明ほか:薬理と治療. 1991;19(7):2873-2893
29
増山善明ほか:薬理と治療. 1991;19(7):2895-2908
30
増山善明ほか:臨床評価. 1991;19(2):213-241
31
猿田享男ほか:薬理と治療. 1993;21(2):505-526
32
山田和生ほか:薬理と治療. 1991;19(8):3189-3203
33
Fujiwara T,et al.:J Hum Hypertens. 2009;23(8):521-529
34
社内資料:アムロジピン5mgで効果不十分な患者に対するアムロジピン10mg長期投与時の安全性及び有効性
35
加藤和三ほか:基礎と臨床. 1992;26(2):683-702
36
加藤和三ほか:臨床評価. 1991;19(3):355-378
37
加藤和三ほか:臨床評価. 1991;19(3):379-404
38
渡邊賢一ほか:薬理と治療. 1991;19(7):2909-2922
39
中村治雄ほか:Progress in Medicine. 1998;18(7):1690-1723
40
山村卓ほか:臨床医薬. 1998;14(11):2031-2054
41
社内資料:家族性高コレステロール血症ホモ接合体患者に対するアトルバスタチンの臨床効果
42
山中教造ほか:日本薬理学雑誌. 1991;97(3):167-178
43
社内資料:アムロジピンの作用機序
44
山中教造ほか:日本薬理学雑誌. 1991;97(2):115-126
45
社内資料:アムロジピンの降圧作用
46
Fleckenstein A,et al.:Am J Cardiol. 1989;64(17):21Ⅰ-34Ⅰ
47
Suzuki M,et al.:Eur J Pharmacol. 1993;228(5-6):269-274
48
社内資料:アムロジピンの抗狭心症作用
49
Nayler WG:Am J Cardiol. 1989;64(17):65Ⅰ-70Ⅰ
50
田村裕男ほか:薬理と治療. 1990;18(Suppl.2):S339-S345
51
舩津敏之ほか:薬理と治療. 1998;26(9):1435-1441
52
田中秀行ほか:薬理と治療. 1998;26(9):1451-1454
53
Bocan TM,et al.:Atherosclerosis. 1994;111(1):127-142
54
Burnett JR,et al.:Arterioscler Thromb Vasc Biol. 1997;17(11):2589-2600
55
Bisgaier CL,et al.:J Lipid Res. 1997;38(12):2502-2515
56
荒井幸規ほか:薬理と治療. 1998;26(9):1475-1481,1483-1486
57
鈴木雅徳ほか:薬理と治療. 1998;26(9):1469-1474
58
社内資料:アトルバスタチン代謝物の薬理作用
59
舩津敏之ほか:薬理と治療. 1998;26(9):1443-1450
60
Funatsu T,et al.:Atherosclerosis. 2001;157(1):107-115
61
角田裕俊ほか:薬理と治療. 1998;26(9):1461-1468