1
Bhatt DL,et al. : N Eng J Med. 2019; 380:11-22.(L20230166)
2
2) Nicholls SJ,et al. : JAMA. 2020; 324:2268–2280.(L20230167)
3
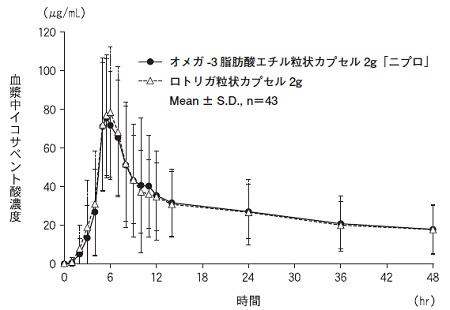
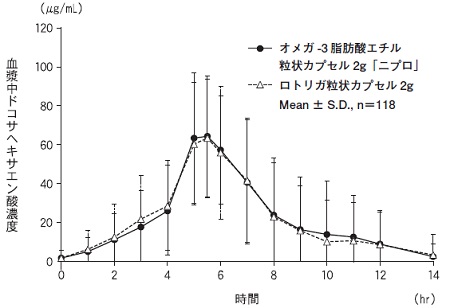
オメガ-3脂肪酸エチルの薬物動態試験成績(ロトリガ粒状カプセル:2012年9月28日承認、CTD 2.7.6.1)(L20220583)
4
オメガ-3脂肪酸エチルの臨床試験成績①(ロトリガ粒状カプセル:2012年9月28日承認、CTD 2.7.6.6)(L20220584)
5
社内資料:生物学的同等性試験
6
イコサペント酸及びドコサヘキサエン酸の蛋白結合に関する検討(ロトリガ粒状カプセル:2012年9月28日承認、CTD 2.6.4.4)(L20220585)
7
代謝(ロトリガ粒状カプセル:2012年9月28日承認、CTD 2.6.4.1.4)(L20230617)
8
Harris WS, et al.:Atherosclerosis. 2008;197:12-24.(L20220586)
9
原健次:生理活性脂質EPA・DHAの生化学と応用. 幸書房. 1996;14-19.(L20220587)
10
Ishiguro J, et al.:Chem Pharm Bull(Tokyo). 1988;36(6):2158-2167.(L20220588)
11
原健次:生理活性脂質EPA・DHAの生化学と応用. 幸書房. 1996;139-146.(L20220589)
12
Yao HT, et al.:Life Sciences. 2006;79:2432-2440.(L20220590)
13
イコサペント酸及びドコサヘキサエン酸の代謝に関する検討(ロトリガ粒状カプセル:2012年9月28日承認、CTD 2.6.4.5)(L20220591)
14
McKenney JM, et al.:J Clin Pharmacol. 2006;46(7):785-791.(L20220592)
15
Di Spirito M, et al.:Expert Opin Pharmacother. 2008;9(17):2939-2945.(L20220593)
16
Gosai P, et al.:Expert Opin Pharmacother. 2008;9(17):2947-2953.(L20220594)
17
全有効性試験の結果の比較検討(ロトリガ粒状カプセル:2012年9月28日承認、CTD 2.7.3.3.2)(L20230618)
18
オメガ-3脂肪酸エチルの臨床試験成績②(ロトリガ粒状カプセル:2012年9月28日承認、CTD 2.7.6.7)(L20220595)
19
TAK-085の脂質低下作用の機序(ロトリガ粒状カプセル:2012年9月28日承認、CTD2.6.2.2.2)(L20230619)
20
Ikeda I, et al.:Biosci Biotechnol Biochem. 1998;62(4):675-680.(L20220596)
21
田中千賀子 ほか:NEW薬理学 改訂第7版 南江堂. 2017: 540-541(L20230620)
22
オメガ-3脂肪酸エチルの非臨床薬理試験成績(ロトリガ粒状カプセル:2012年9月28日承認、CTD 2.6.2.2)(L20220597)