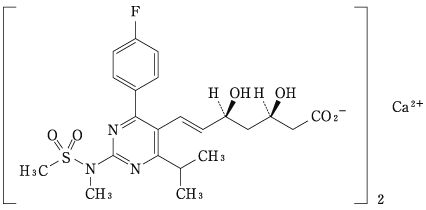
1
Zurth, C. et al.:Eur. J. Drug Metab. Pharmacokinet., 2019;44(6):747-759
2
単回投与後の血漿中濃度(クレストール錠:2005年1月19日承認、申請資料概要へ3.3.1.2)
3
Martin, P. D. et al.:Clin. Ther., 2003;25(8):2215-2224
4
反復投与後の血漿中濃度(クレストール錠:2005年1月19日承認、申請資料概要へ3.4)
5
関野久邦他:臨床医薬, 2005;21(2):187-203
6
患者における血漿中濃度(クレストール錠:2005年1月19日承認、申請資料概要へ3.6)
7
反復投与(クレストール錠:2005年1月19日承認、申請資料概要へ3.7.8)
8
Martin, P. D. et al.:Br. J. Clin. Pharmacol., 2002;54(5):472-477
9
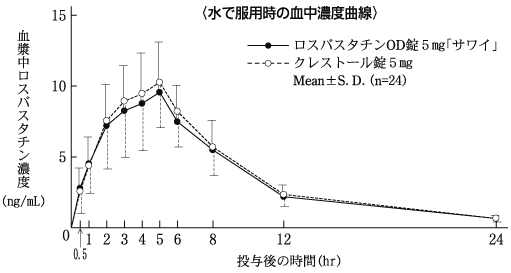
社内資料:生物学的同等性試験(錠5mg)
10
社内資料:生物学的同等性試験(OD錠5mg)
11
生物学的利用率(クレストール錠:2005年1月19日承認、申請資料概要へ3.5)
12
食事の影響(クレストール錠:2005年1月19日承認、申請資料概要へ3.7.5)
13
蛋白結合率(クレストール錠:2005年1月19日承認、申請資料概要へ2.2.5)
14
尿糞中排泄率(クレストール錠:2005年1月19日承認、申請資料概要へ3.7.9.5)
15
HMG-CoA還元酵素阻害活性体の血漿中濃度(クレストール錠:2005年1月19日承認、申請資料概要へ3.7.9.4)
16
Martin, P. D. et al.:J. Clin. Pharmacol., 2002;42(10):1116-1121
17
Simonson, S. G. et al.:Eur. J. Clin. Pharmacol., 2003;58(10):669-675
18
腎障害の影響(クレストール錠:2005年1月19日承認、申請資料概要へ3.7.11)
19
薬物相互作用−制酸剤(クレストール錠:2005年1月19日承認、申請資料概要へ3.7.12.2(f))
20
Simonson, S. G. et al.:Clin. Pharmacol. Ther., 2004;76(2):167-177
21
Schneck, D. W. et al.:Clin. Pharmacol. Ther., 2004;75(5):455-463
22
Cooper, K. J. et al.:Eur. J. Clin. Pharmacol., 2002;58(8):527-531
23
Cooper, K. J. et al.:Br. J. Clin. Pharmacol., 2003;55(1):94-99
24
Cooper, K. J. et al.:Clin. Pharmacol. Ther., 2003;73(4):322-329
25
Cooper, K. J. et al.:Eur. J. Clin. Pharmacol., 2003;59(1):51-56
26
Simonson, S. G. et al.:J. Clin. Pharmacol., 2005;45(8):927-934
27
Martin, P. D. et al.:J. Clin. Pharmacol., 2002;42(12):1352-1357
28
Simonson, S. G. et al.:Br. J. Clin. Pharmacol., 2004;57(3):279-286
29
McCormick, A. D. et al.:J. Clin. Pharmacol., 2000;40:1055
30
in vitro試験(クレストール錠:2005年1月19日承認、申請資料概要へ3.7.9.1)
31
社内資料:生物学的同等性試験(錠2.5mg)
32
社内資料:生物学的同等性試験(OD錠2.5mg)
33
Schneck, D. W. et al.:Am. J. Cardiol., 2003;91(1):33-41
34
海外第Ⅲ相用量反応試験(クレストール錠:2005年1月19日承認、申請資料概要ト1.3.2)
35
日本人高コレステロール血症患者における有効性(クレストール錠:2005年1月19日承認、申請資料概要ト1.2.3)
36
外国人高コレステロール血症患者における有効性(クレストール錠:2005年1月19日承認、申請資料概要ト2.1.2.1)
37
外国人高コレステロール血症患者の長期投与における有効性(クレストール錠:2005年1月19日承認、申請資料概要ト1.5.2)
38
Olsson, A. G. et al.:Am. Heart J., 2002;144(6):1044-1051
39
Mabuchi, H. et al.:J. Atheroscler. Thromb., 2004;11(3):152-158
40
国内第Ⅱ相長期投与試験(クレストール錠:2005年1月19日承認、申請資料概要ト1.4.2)
41
Nezasa, K. et al.:Xenobiotica, 2003;33(4):379-388
42
作用機序(クレストール錠:2005年1月19日承認、申請資料概要ホ1)
43
McTaggart, F. et al.:Am. J. Cardiol., 2001;87(5A):28B-32B
44
LDL受容体に対する作用(クレストール錠:2005年1月19日承認、申請資料概要ホ1.2.3)
45
イヌの血中脂質に対する作用(クレストール錠:2005年1月19日承認、申請資料概要ホ1.1.1)
46
カニクイザルの血清コレステロール及びリポ蛋白コレステロールに対する作用(クレストール錠:2005年1月19日承認、申請資料概要ホ1.1.2)
47
WHHLウサギの血清コレステロール及び動脈硬化病変に対する作用(クレストール錠:2005年1月19日承認、申請資料概要ホ1.1.3)
48
アポ蛋白E*3Leidenトランスジェニックマウスに対する作用(クレストール錠:2005年1月19日承認、申請資料概要ホ1.1.4)
49
ヒトアポ蛋白B/CETPトランスジェニックマウスに対する作用(クレストール錠:2005年1月19日承認、申請資料概要ホ1.1.5)