1
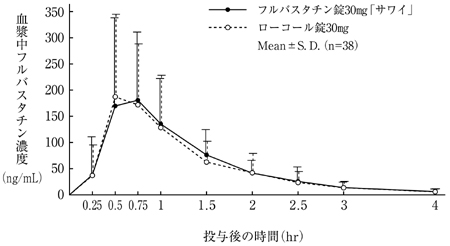
社内資料:生物学的同等性試験(錠30mg)
2
Fischer, V. et al.:Drug Metab. Dispo., 1999;27(3):410-416
3
社内資料:生物学的同等性試験(錠10mg)
4
社内資料:生物学的同等性試験(錠20mg)
5
Yamamoto, A. et al.:Experientia, 1995;51(3):223-226
6
Kurokawa, J. et al.:Biochim. Biophys. Acta, 1995;1259(1):99-104