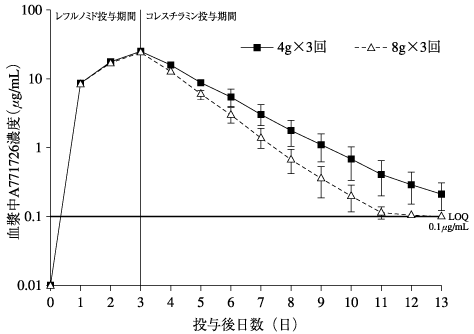
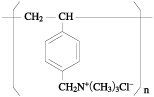
1
横島徹熹 他:基礎と臨床. 1982;16(8):4187-96
2
重松 洋 他:動脈硬化. 1982;10(1):143-54
3
重松 洋 他:臨牀と研究. 1983;60(8):2783-7
4
内藤周幸 他:薬理と治療. 1983;11(8):3157-64
5
松沢佑次 他:動脈硬化. 1983;11(3):693-711
6
馬渕 宏 他:臨牀と研究. 1983;60(9):3103-9
7
五島雄一郎 他:医学のあゆみ. 1983;125(12):1058-94
8
保田国伸 他:新薬と臨牀. 2003;52(7):959-68
9
藤井道也 他:基礎と臨床. 1982;16(14):7699-714
10
Huff J W, et al.:Proc Soc Exp Biol Med. 1963;114:352-5
11
安田耕太郎 他:基礎と臨床. 1982;16(11):5741-59
12
北島省吾 他:基礎と臨床. 1982;16(11) :5760-79
13
Kim D N, et al.:Exp Mol Pathol. 1979;31:318-32
14
Vahouny G V, et al.:Am J Clin Nutr. 1978;31:S208-10
15
安田耕太郎 他:基礎と臨床. 1982;16(11):5721-34