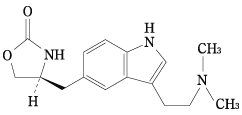
1
International Headache Society:Cephalalgia, 2018;38(1):1-211
2
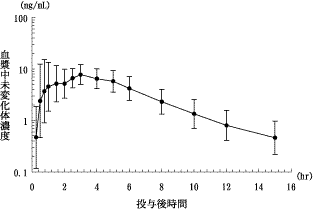
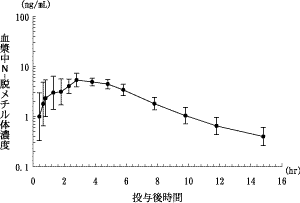
社内資料:日本人ならびに白人における薬物動態比較試験(2001年6月20日承認、申請資料概要ヘ.3.4.1)
3
社内資料:性別による薬物動態への影響(2001年6月20日承認、申請資料概要ヘ.3.6)
4
Seaber, E. et al.:Br. J. Clin. Pharmacol., 1997;43:579-587
5
社内資料:欧米人健康成人男女を対象とした単回投与試験(2001年6月20日承認、申請資料概要ヘ.3.2.2)
6
社内資料:健康成人被験者における絶対生物学的利用率(2001年6月20日承認、申請資料概要ヘ.3.5)
7
社内資料:日本人健康成人男性を対象とした反復投与試験(2001年6月20日承認、申請資料概要ヘ.3.3.2)
8
Seaber, E. J. et al.:Br. J. Clin. Pharmacol., 1998;46:433-439
9
社内資料:血漿蛋白質との結合(2001年6月20日承認、申請資料概要ヘ.2.2.4)
10
Gillotin, C. et al.:Int. J. Clin. Pharmacol. Ther., 1997;35(11):522-526
11
Dixon, R. et al.:J. Clin. Pharmacol., 1998;38:694-701
12
Rolan, P.:Cephalalgia, 1997;17(Suppl. 18):21-27
13
Dixon, R. M. et al.:Cephalalgia, 1997;17:639-646
14
Peck, R. W. et al.:Br. J. Clin. Pharmacol., 1997;44:595-599
15
Seaber, E. J. et al.:Eur. J. Clin. Pharmacol., 1997;53:229-234
16
Dixon, R. et al.:Clin. Drug Invest., 1998;15(6):515-522
17
Smith, D. A. et al.:Int. J. Clin. Pharmacol. Ther., 1998;36(6):301-305
18
社内資料:無作為化プラセボ対照二重盲検比較試験
19
Martin, G. R. et al.:Br. J. Pharmacol., 1997;121:157-164
20
社内資料:183C91(活性代謝物)の受容体選択性(2001年6月20日承認、申請資料概要ホ.1.3.2)
21
MacLennan, S. J. et al.:Eur. J. Pharmacol., 1998;361:191-197
22
Goadsby, P. J. et al.:Headache, 1994;34:394-399
23
社内資料:麻酔下モルモットにおける神経因性血漿蛋白漏出に対する作用(2001年6月20日承認、申請資料概要ホ.1.2.4)
24
Goadsby, P. J. et al.:Cephalalgia, 1997;17:153-158
25
Goadsby, P. J. et al.:Pain, 1996;67:355-359