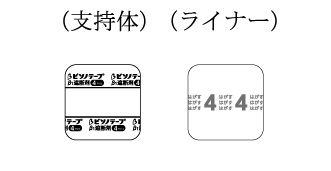
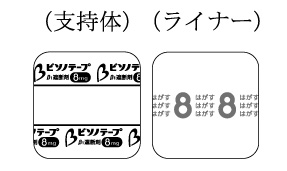
1
トーアエイヨー社内資料:薬物動態試験;単回投与(2013年6月28日承認、申請資料概要2.7.6.1)
2
トーアエイヨー社内資料:薬物動態試験;反復投与(2013年6月28日承認、申請資料概要2.7.6.2)
3
トーアエイヨー社内資料:腎機能別の薬物動態試験(2013年6月28日承認、申請資料概要2.7.6.2)
4
Matsuoka H,et al.:J Clin Hypertens.2013;15(11):806-814
5
トーアエイヨー社内資料:本態性高血圧症(Ⅰ度・Ⅱ度)に対する第Ⅲ相検証試験(2013年6月28日承認、申請資料概要2.7.6.3)
6
Yamashita T,et al.:J Cardiol.2019;73(5):386-393
7
トーアエイヨー社内資料:慢性心房細動に対する第Ⅲ相検証試験
8
トーアエイヨー社内資料:受容体親和性(2013年6月28日承認、申請資料概要2.6.2.2)
9
トーアエイヨー社内資料:ラットにおける降圧作用(2013年6月28日承認、申請資料概要2.6.2.2)
10
トーアエイヨー社内資料:イヌにおける降圧作用(2013年6月28日承認、申請資料概要2.6.2.2)




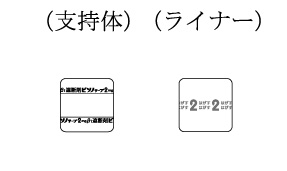
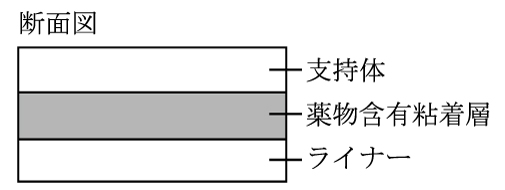
 643(アルミ袋に表示)
643(アルミ袋に表示)