1
阿部真也ほか:周産期医学.2017;47:1353-1355.
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌.2021;29:49-54.
3
アジルサルタンの薬物動態試験成績①(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.3)
4
アジルサルタンの薬物動態試験成績②(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.5)
5
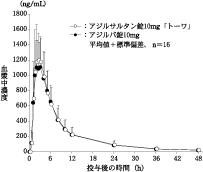
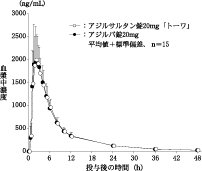
社内資料:生物学的同等性試験(錠10mg)
6
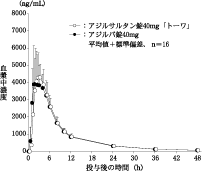
社内資料:生物学的同等性試験(錠20mg)
7
社内資料:生物学的同等性試験(錠40mg)
8
アジルサルタンの薬物動態試験成績③(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.1)
9
アジルサルタンの蛋白結合に関する検討(アジルバ錠:2012年1月18日承認、申請資料概要 2.6.4.4)
10
アジルサルタンの代謝に関する検討①(アジルバ錠:2012年1月18日承認、申請資料概要 2.6.4.1)
11
アジルサルタンの代謝に関する検討②(アジルバ錠:2012年1月18日承認、申請資料概要 2.6.2.1)
12
腎機能障害患者における薬物動態試験成績(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.2.2、2.7.6.16)
13
アジルサルタンの臨床試験成績①(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.2.2、2.7.6.30)
14
肝機能障害者における薬物動態試験成績(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.17)
15
アジルサルタンの薬物動態試験成績④(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.15)
16
フルコナゾールとの薬物相互作用試験成績(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.18)
17
アジルサルタンの臨床試験成績②(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.26)
18
アジルサルタンの臨床試験成績③(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.27)
19
アジルサルタンの臨床試験成績④(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.28)
20
アジルサルタンの臨床試験成績⑤(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.29)
21
アジルサルタンの臨床試験成績⑥(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.4.5)
22
アジルサルタンの臨床試験成績⑦(アジルバ錠:2012年1月18日承認、申請資料概要 2.7.6.30)
23
アジルサルタンの薬理作用(アジルバ錠:2012年1月18日承認、申請資料概要 2.6.1)
24
アジルサルタンの降圧作用に関する検討(アジルバ錠:2012年1月18日承認、申請資料概要 2.6.2.2)











 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379

