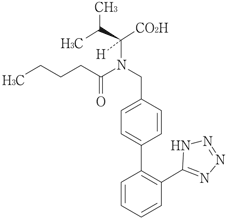
1
Sheps, S.G. et al.:Arch.Intern.Med. 1997;157(21):2413-2446
2
阿部真也ほか:周産期医学. 2017;47(10):1353-1355
3
齊藤大祐ほか:鹿児島産科婦人科学会雑誌. 2021;29:49-54
4
Briggs, G.G. et al.:Ann.Pharmacother. 2001;35(7-8):859-861
5
Cooper, W.O. et al.:N.Engl.J.Med. 2006;354(23):2443-2451
6
単回投与(ディオバン錠:2000年9月22日承認、申請資料概要ヘ.3.(1).1))
7
単回投与(ディオバン錠:2012年8月24日承認、公知申請への該当性に係る報告書)
8
反復投与(ディオバン錠:2000年9月22日承認、申請資料概要ヘ.3.(1).1))
9
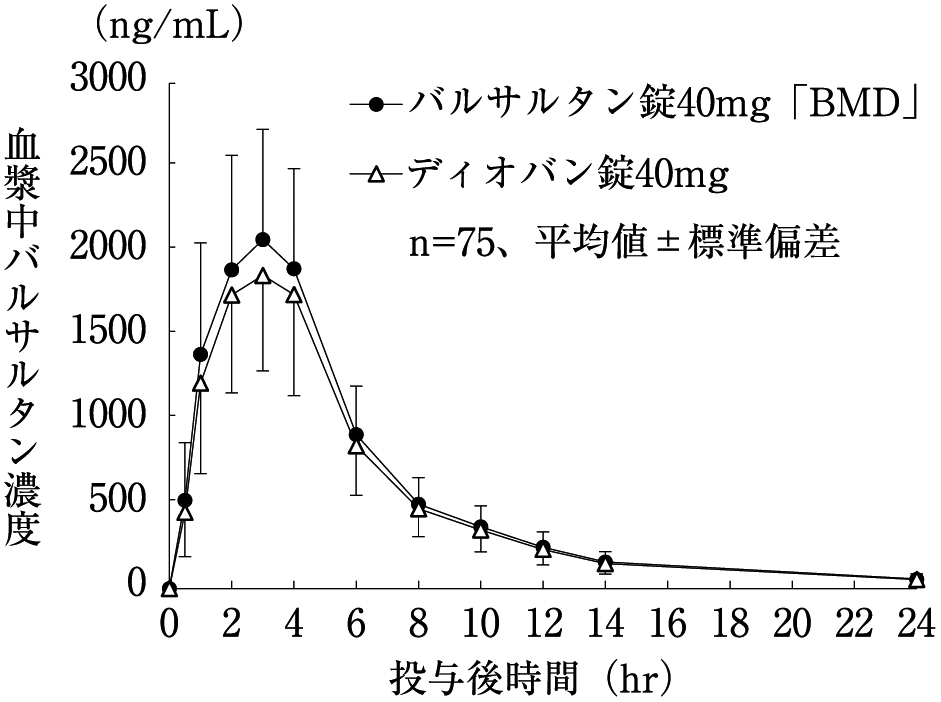
社内資料:生物学的同等性試験(40mg製剤)
10
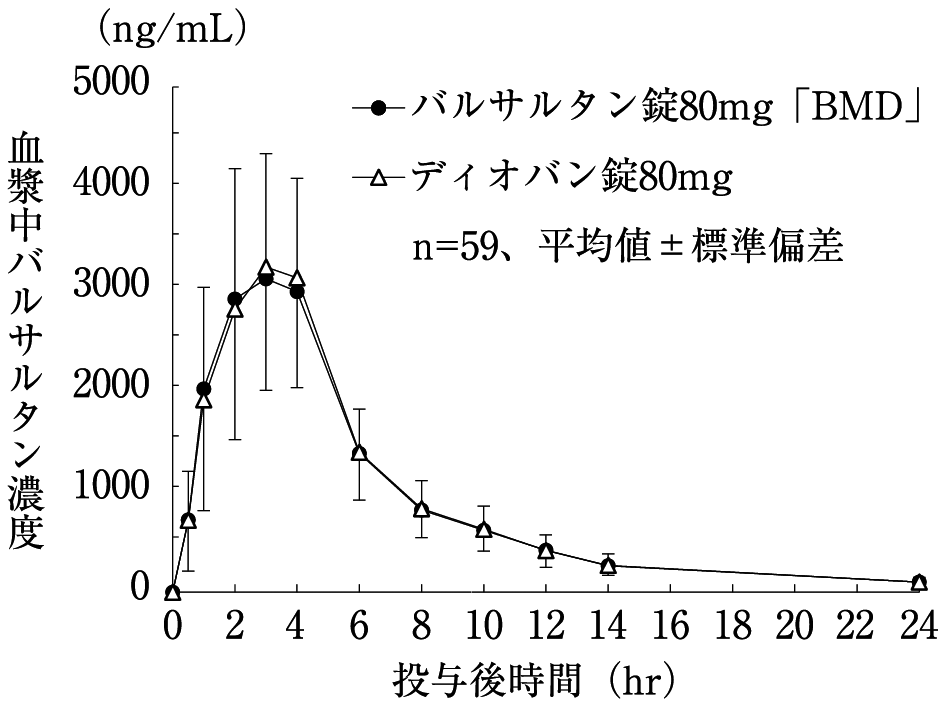
社内資料:生物学的同等性試験(80mg製剤)
11
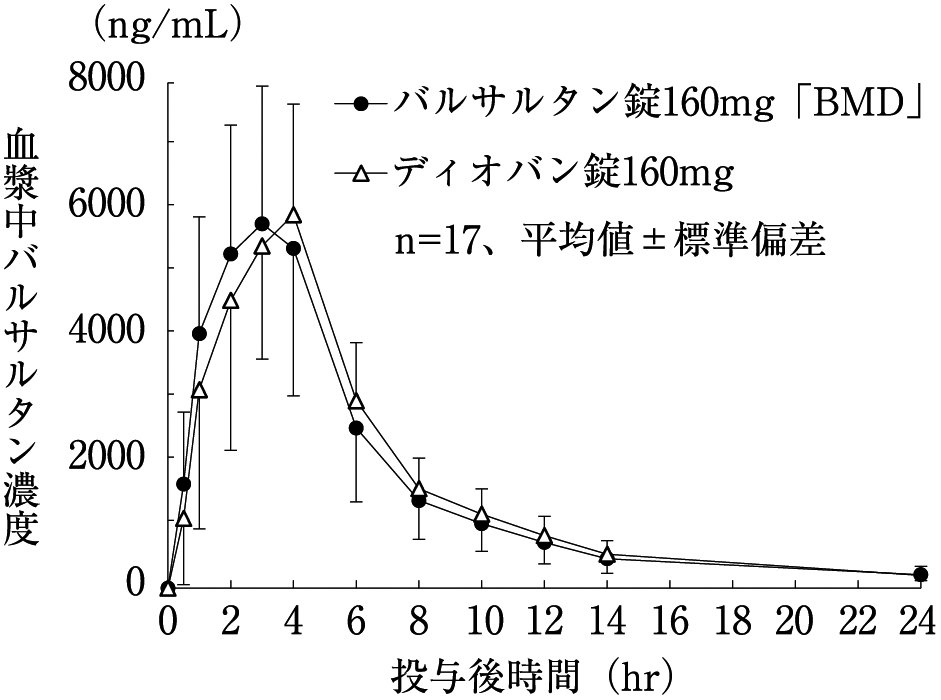
社内資料:生物学的同等性試験(160mg製剤)
12
代謝(ディオバン錠:2000年9月22日承認、申請資料概要ヘ.3.(1).2))
13
Waldmeier, F. et al.:Xenobiotica. 1997;27(1):59-71
14
排泄(ディオバン錠:2000年9月22日承認、申請資料概要ヘ.3.(1).3))
15
Sioufi, A. et al.:Biopharm. Drug Dispos. 1998;19(4):237-244
16
高齢者(ディオバン錠:2000年9月22日承認、申請資料概要へ.3.(3))
17
社内資料:溶出性試験(20mg製剤)
18
社内資料:溶出性試験(40mg製剤)
19
社内資料:溶出性試験(80mg製剤)
20
社内資料:溶出性試験(160mg製剤)
21
国内臨床試験(第Ⅱ相及び第Ⅲ相)(ディオバン錠:2000年9月22日承認、申請資料概要ト.2.(1))
22
国内臨床試験(第Ⅱ相及び第Ⅲ相)(ディオバン錠:2000年9月22日承認、申請資料概要ト.1.(6).2))
23
国内臨床試験(第Ⅱ相及び第Ⅲ相)(ディオバン錠:2000年9月22日承認、申請資料概要ト.1.(8).3))
24
国内臨床試験(第Ⅱ相及び第Ⅲ相)(ディオバン錠:2000年9月22日承認、申請資料概要ト.1.(7))
25
国内臨床試験(第Ⅱ相及び第Ⅲ相)(ディオバン錠:2000年9月22日承認、申請資料概要ト.1.(5))
26
国内第Ⅱ相試験(ディオバン錠:2000年9月22日承認、申請資料概要ト.1.(9))
27
作用機序(ディオバン錠:2000年9月22日承認、申請資料概要ホ.1.(2))
28
降圧作用(ディオバン錠:2000年9月22日承認、申請資料概要ホ.1.(1).1))
29
血行動態並びに心臓に及ぼす作用(ディオバン錠:2000年9月22日承認、申請資料概要ホ.1.(1).2))
30
腎機能に及ぼす作用(ディオバン錠:2000年9月22日承認、申請資料概要ホ.1.(1).3))