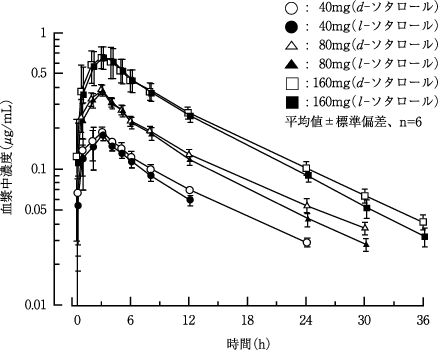
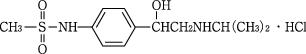
1
木村雅彦他:臨床医薬. 1995;11(12):2521-2530
2
清水孝容他:薬物動態. 1995;10(4):547-555
3
O'Hare M.F. et al.:Br. J. Obstet. Gynaecol. 1980;87:814-820
4
Hanyok J.J.:Am. J. Cardiol. 1993;72:19A-26A
5
Blair A.D. et al.:Clin. Pharmacol. Ther. 1981;29(4):457-463
6
加藤和三他:臨床医薬. 1998;14(14):2603-2636
7
Mason J.W. et al.:N. Engl. J. Med. 1993;329(7):452-458
8
Gomoll A.W. et al.:Arzneimittelforschung. 1987;37(11):787-794
9
Cobbe S.M. et al.:Circulation. 1983;68(4):865-871
10
Patterson E. et al.:J. Pharmacol. Exp. Ther. 1984;230(2):519-526
11
Gomoll A.W. et al.:Eur. J. Pharmacol. 1986;132:123-135
12
Gomoll A.W. et al.:Advances in beta-adrenergic blocking therapy-sotalol. Snart A.G.(ed.), Excerpta Medica(Amsterdam), Vol.1 1974:6-22
13
Lathrop D.A. et al.:Can. J. Physiol. Pharmacol. 1985;63(12):1506-1512
14
Carmeliet E.:J. Pharmacol. Exp. Ther. 1985;232(3):817-825