添付文書番号
2123016F1123_1_09
企業コード
480235
作成又は改訂年月
日本標準商品分類番号
872123
薬効分類名
選択的β1アンタゴニスト
承認等
販売名
ビソプロロールフマル酸塩錠0.625mg「トーワ」
販売名コード
販売名英字表記
BISOPROLOL FUMARATE TABLETS 0.625mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
ビソプロロールフマル酸塩錠2.5mg「トーワ」
販売名コード
販売名英字表記
BISOPROLOL FUMARATE TABLETS 2.5mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
ビソプロロールフマル酸塩錠5mg「トーワ」
販売名コード
販売名英字表記
BISOPROLOL FUMARATE TABLETS 5mg “TOWA”
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
一般的名称
ビソプロロールフマル酸塩錠
警告
〈慢性心不全〉
慢性心不全治療の経験が十分にある医師のもとで使用すること。
投与初期及び増量時に症状が悪化することに注意し、慎重に用量調節を行うこと。
禁忌(次の患者には投与しないこと)
高度の徐脈(著しい洞性徐脈)、房室ブロック(Ⅱ、Ⅲ度)、洞房ブロック、洞不全症候群のある患者[症状を悪化させるおそれがある。]
糖尿病性ケトアシドーシス、代謝性アシドーシスのある患者[アシドーシスに基づく心収縮力の抑制を増強させるおそれがある。]
心原性ショックのある患者[心機能が抑制され、症状を悪化させるおそれがある。]
肺高血圧による右心不全のある患者[心機能が抑制され、症状を悪化させるおそれがある。]
強心薬又は血管拡張薬を静脈内投与する必要のある心不全患者[心収縮力抑制作用により、心不全が悪化するおそれがある。]
非代償性の心不全患者[心収縮力抑制作用により、心不全が悪化するおそれがある。]
重度の末梢循環障害のある患者(壊疽等)[末梢血管の拡張を抑制し、症状を悪化させるおそれがある。]
未治療の褐色細胞腫又はパラガングリオーマの患者
本剤の成分に対し過敏症の既往歴のある患者
組成・性状
組成
ビソプロロールフマル酸塩錠0.625mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 ビソプロロールフマル酸塩 0.625mg |
|---|
添加剤 | D-マンニトール、ステアリン酸マグネシウム |
|---|
ビソプロロールフマル酸塩錠2.5mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 ビソプロロールフマル酸塩 2.5mg |
|---|
添加剤 | D-マンニトール、ステアリン酸マグネシウム |
|---|
ビソプロロールフマル酸塩錠5mg「トーワ」
有効成分 | 1錠中 |
|---|
有効成分 | 日局 ビソプロロールフマル酸塩 5mg |
|---|
添加剤 | D-マンニトール、アルファー化デンプン、ステアリン酸マグネシウム |
|---|
製剤の性状
ビソプロロールフマル酸塩錠0.625mg「トーワ」
| 剤形 | 楕円形の割線入りの素錠 |
|---|
| 色調 | 白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(長径) 7.1mm 大きさ(短径) 4.0mm 大きさ(厚さ) 2.4mm |
|---|
| 質量 | 60mg |
|---|
| 識別コード | Tw700 |
|---|
ビソプロロールフマル酸塩錠2.5mg「トーワ」
| 剤形 | 割線入りの素錠 |
|---|
| 色調 | 白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 6.0mm 大きさ(厚さ) 3.1mm |
|---|
| 質量 | 90mg |
|---|
| 識別コード | Tw128 |
|---|
ビソプロロールフマル酸塩錠5mg「トーワ」
| 剤形 | 割線入り素錠 |
|---|
| 色調 | 白色 |
|---|
| 外形 | 表面 裏面 側面 |
|---|
| 大きさ | 大きさ(直径) 7.0mm 大きさ(厚さ) 2.6mm |
|---|
| 質量 | 100mg |
|---|
| 識別コード | Tw129 |
|---|
効能又は効果
用法及び用量
〈本態性高血圧症(軽症~中等症)、狭心症、心室性期外収縮〉
通常、成人にはビソプロロールフマル酸塩として、5mgを1日1回経口投与する。なお、年齢、症状により適宜増減する。
〈虚血性心疾患又は拡張型心筋症に基づく慢性心不全〉
通常、成人にはビソプロロールフマル酸塩として、1日1回0.625mg経口投与から開始する。1日1回0.625mgの用量で2週間以上経口投与し、忍容性がある場合には、1日1回1.25mgに増量する。その後忍容性がある場合には、4週間以上の間隔で忍容性をみながら段階的に増量し、忍容性がない場合は減量する。用量の増減は1回投与量を0.625、1.25、2.5、3.75又は5mgとして必ず段階的に行い、いずれの用量においても、1日1回経口投与とする。通常、維持量として1日1回1.25~5mgを経口投与する。
なお、年齢、症状により、開始用量は更に低用量に、増量幅は更に小さくしてもよい。また、患者の本剤に対する反応性により、維持量は適宜増減するが、最高投与量は1日1回5mgを超えないこと。
〈頻脈性心房細動〉
通常、成人にはビソプロロールフマル酸塩として、1日1回2.5mg経口投与から開始し、効果が不十分な場合には1日1回5mgに増量する。なお、年齢、症状により適宜増減するが、最高投与量は1日1回5mgを超えないこと。
用法及び用量に関連する注意
〈効能共通〉
褐色細胞腫又はパラガングリオーマの患者では、α遮断剤で初期治療を行った後に本剤を投与し、常にα遮断剤を併用すること。
〈本態性高血圧症、狭心症、心室性期外収縮、頻脈性心房細動〉
慢性心不全を合併する患者では、慢性心不全の用法及び用量に従うこと。
〈本態性高血圧症、狭心症、心室性期外収縮〉
頻脈性心房細動を合併する本態性高血圧症、狭心症の患者又は心室性期外収縮のある患者に投与する場合、頻脈性心房細動の用法及び用量は1日1回2.5mgから開始することに留意した上で、各疾患の指標となる血圧や心拍数、症状等に応じ、開始用量を設定すること。
〈慢性心不全〉
必ず1日1回0.625mg又は更に低用量から開始し、忍容性を基に患者毎に維持量を設定すること。
2週間以上休薬した後、投与を再開する場合には、用法及び用量に従って、低用量から開始し、段階的に増量すること。
重要な基本的注意
〈効能共通〉
投与が長期にわたる場合は、心機能検査(脈拍、血圧、心電図、X線等)を定期的に行うこと。徐脈又は低血圧の症状があらわれた場合には減量又は投与を中止すること。また、必要に応じアトロピンを使用すること。なお、肝機能、腎機能、血液像等に注意すること。
類似化合物(プロプラノロール塩酸塩)使用中の狭心症患者で急に投与を中止したとき、症状が悪化したり、心筋梗塞を起こした症例が報告されているので、休薬を要する場合は徐々に減量し、観察を十分に行うこと。また、患者に医師の指示なしに服薬を中止しないよう注意すること。狭心症以外の適用、例えば不整脈で投与する場合でも、特に高齢者においては同様の注意をすること。
手術前48時間は投与しないことが望ましい。
めまい、ふらつきがあらわれることがあるので、本剤投与中の患者(特に投与初期)には自動車の運転等危険を伴う機械を操作する際には注意させること。
〈慢性心不全〉
慢性心不全患者に投与する場合には、本剤の投与初期及び増量時は、入院下で投与することが望ましい。
重症慢性心不全患者に対する本剤の投与では特に慎重な管理を要するので、投与初期及び増量時は入院下で投与すること。
本剤の投与初期及び増量時は、心不全の悪化、浮腫、体重増加、めまい、低血圧、徐脈、血糖値の変動及び腎機能の悪化が起こりやすいので、観察を十分に行い、忍容性を確認すること。
本剤の投与初期又は増量時における心不全や体液貯留の悪化(浮腫、体重増加等)を防ぐため、本剤の投与前に体液貯留の治療を十分に行うこと。心不全や体液貯留の悪化(浮腫、体重増加等)がみられ、利尿薬増量で改善がみられない場合には本剤を減量又は中止すること。低血圧、めまいなどの症状がみられ、アンジオテンシン変換酵素阻害薬や利尿薬の減量により改善しない場合には本剤を減量すること。高度な徐脈を来たした場合には、本剤を減量すること。また、これら症状が安定化するまで本剤を増量しないこと。
本剤の投与を急に中止した場合、心不全が一過性に悪化するおそれがあるので、本剤を中止する場合には、急に投与を中止せず、原則として徐々に減量し中止すること。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
〈効能共通〉
気管支喘息、気管支痙れんのおそれのある患者
気管支を収縮させ、症状を発現させるおそれがある。
特発性低血糖症、コントロール不十分な糖尿病、長期間絶食状態の患者
血糖値に注意すること。低血糖の前駆症状である頻脈等の交感神経系反応をマスクしやすい。
甲状腺中毒症の患者
休薬を要する場合には徐々に減量し、観察を十分に行うこと。急に投与を中止すると、症状を悪化させることがある。
頻脈等の中毒症状をマスクすることがある。
末梢循環障害のある患者(レイノー症候群、間欠性跛行症等)
末梢血管の拡張を抑制し、症状を悪化させるおそれがある。
徐脈、房室ブロック(Ⅰ度)のある患者
心刺激伝導系を抑制し、症状を悪化させるおそれがある。
過度に血圧の低い患者
血圧を更に低下させるおそれがある。
異型狭心症の患者
症状を悪化させるおそれがある。
乾癬の患者又は乾癬の既往のある患者
症状を悪化又は誘発させるおそれがある。
褐色細胞腫又はパラガングリオーマの患者
本剤の単独投与により急激に血圧が上昇することがある。
〈頻脈性心房細動〉
心不全を合併する患者
心機能検査を行う等、観察を十分に行うこと。心不全の症状を悪化させる可能性がある。
腎機能障害患者
重篤な腎機能障害のある患者
薬物の排泄が遅延し、作用が増強するおそれがある。
肝機能障害患者
重篤な肝機能障害のある患者
薬物の代謝が遅延し、作用が増強するおそれがある。
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。投与に際しては、母体及び胎児の状態を十分に観察すること。また、出生後も新生児の状態を十分に観察し、新生児の低血糖、徐脈、哺乳不良等の異常が認められた場合には適切な処置を行うこと。
妊婦にβ遮断薬を投与した場合に、胎児の発育不全、新生児の低血糖、徐脈、哺乳不良等が認められたとの報告がある。また、動物実験(ラット、ウサギ)で胎児毒性(致死、発育抑制)及び新生児毒性(発育毒性等)が報告されている(安全域注):ラット胎児で58倍、ウサギ胎児で39倍、ラット新生児で19倍)。
授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている。
小児等
高齢者
次の点に注意し、少量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。
相互作用
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
交感神経系に対し抑制的に作用する薬剤 レセルピン等 | 過剰の交感神経抑制作用(徐脈、血圧低下等)があらわれることがある。
異常が認められた場合には両剤の減量若しくは投与を中止する。 | 相加的に作用(交感神経抑制作用)を増強させる。 |
血糖降下剤 インスリン製剤等 | 血糖降下作用が増強することがある。また、低血糖症状(頻脈、発汗等)をマスクすることがある。
血糖値に注意し、異常が認められた場合には本剤の減量若しくは投与を中止する。 | β2遮断により肝臓でのグリコーゲン分解が抑制される。また、低血糖時に分泌されるアドレナリンにより生じる低血糖症状をマスクする。 |
Ca拮抗剤 ベラパミル塩酸塩 ジルチアゼム塩酸塩等 | 徐脈、房室ブロック、洞房ブロック等があらわれることがある。
定期的に脈拍数を測定し、必要に応じて心電図検査を行い、異常が認められた場合には、両剤の減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用、陰性変力作用、降圧作用)を増強させる。特にジギタリス製剤との3剤併用時には注意を要する。 |
ジギタリス製剤 ジゴキシン メチルジゴキシン | 徐脈、房室ブロック等があらわれることがある。
定期的に心電図検査を行い、異常が認められた場合には、両剤の減量若しくは投与を中止する。 | 相加的に作用(心刺激生成・伝導抑制作用)を増強させる。特にCa拮抗剤との3剤併用時には注意を要する。 |
クロニジン塩酸塩 グアナベンズ酢酸塩 | クロニジン、グアナベンズ投与中止後のリバウンド現象(急激な血圧上昇)が増強することがある。
クロニジンを中止する場合は、あらかじめ本剤の投与中止等適切な処置を行う。 | クロニジンを中止した場合、血中ノルアドレナリンが上昇する。β遮断剤と併用している場合、クロニジンの中止により、α作用が強調され、より急激な血圧上昇を起こす。グアナベンズも作用機序から同様な反応が予測される。 |
クラスⅠ抗不整脈剤 リン酸ジソピラミド プロカインアミド塩酸塩等 クラスⅢ抗不整脈剤 アミオダロン塩酸塩 | 過度の心機能抑制(徐脈、低血圧等)があらわれることがある。
臨床症状を観察し、異常が認められた場合には本剤の減量若しくは投与を中止する。 | 相加的に作用(交感神経抑制作用)を増強させる。 |
非ステロイド性抗炎症剤 インドメタシン等 | 本剤の降圧作用が減弱することがある。 | 非ステロイド性抗炎症剤は、血管拡張作用を有するプロスタグランジンの合成・遊離を阻害する。 |
降圧作用を有する薬剤 降圧剤 硝酸剤 | 降圧作用が増強することがある。
定期的に血圧を測定し、両剤の用量を調節する。 | 相加的に作用(降圧作用)を増強させる。 |
フィンゴリモド塩酸塩 | フィンゴリモド塩酸塩の投与開始時に併用すると重度の徐脈や心ブロックが認められることがある。 | 共に徐脈や心ブロックを引き起こすおそれがある。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
心不全(高血圧症等の場合:頻度不明、慢性心不全の場合:7.0%)、完全房室ブロック、高度徐脈、洞不全症候群(高血圧症等の場合:いずれも頻度不明、慢性心不全の場合:いずれも頻度不明)
その他の副作用
〈本態性高血圧症、狭心症、心室性期外収縮、頻脈性心房細動〉
| 0.1~5%未満 | 頻度不明 |
|---|
循環器 | 徐脈、心胸比増大、低血圧、動悸、心室性期外収縮 | 房室ブロック、心房細動、胸痛 |
|---|
精神神経系 | 頭痛・頭重感、めまい、ふらつき、立ちくらみ、眠気、不眠 | 悪夢 |
|---|
消化器 | 悪心、嘔吐、胃部不快感、腹部不快感、食欲不振 | 下痢 |
|---|
肝臓 | AST、ALT、ビリルビン、LDH、ALP、γ-GTPの上昇 | 肝腫大 |
|---|
腎臓・泌尿器 | 尿酸、クレアチニン、BUNの上昇、尿糖、頻尿 | |
|---|
呼吸器 | 呼吸困難 | 気管支痙れん |
|---|
過敏症 | 発疹 | 皮膚そう痒感 |
|---|
眼 | | 霧視、涙液分泌減少 |
|---|
その他 | 倦怠感、浮腫、脱力感、気分不快感、疲労感、四肢冷感、悪寒、しびれ感、CKの上昇 | 糖尿病増悪、血清脂質の上昇 |
|---|
注1)発現頻度は本態性高血圧症、狭心症、心室性期外収縮及び頻脈性心房細動の国内臨床試験の結果をあわせて算出した。
| 5%以上 | 0.1~5%未満 | 頻度不明 |
|---|
循環器 | 徐脈 | 心胸比増大、房室ブロック、低血圧、動悸、胸痛 | 心房細動、心室性期外収縮 |
|---|
精神神経系 | めまい(16.0%)、立ちくらみ | 頭痛・頭重感、ふらつき、眠気、不眠 | 悪夢 |
|---|
消化器 | | 悪心、腹部不快感、食欲不振 | 嘔吐、胃部不快感、下痢 |
|---|
肝臓 | AST、ALTの上昇 | 肝腫大、ビリルビン、LDH、ALP、γ-GTPの上昇 | |
|---|
腎臓・泌尿器 | 尿酸、クレアチニンの上昇 | BUNの上昇、尿糖、頻尿 | |
|---|
呼吸器 | 呼吸困難(11.0%) | | 気管支痙れん |
|---|
過敏症 | | 発疹 | 皮膚そう痒感 |
|---|
眼 | | 霧視 | 涙液分泌減少 |
|---|
その他 | 倦怠感(10.0%)、浮腫(11.0%)、血清脂質の上昇 | 脱力感、気分不快感、疲労感、四肢冷感、しびれ感、CKの上昇、糖尿病増悪 | 悪寒 |
|---|
注2)発現頻度は慢性心不全の国内臨床試験より算出した。
過量投与
症状
徐脈、完全房室ブロック、心不全、低血圧、気管支痙れん等があらわれることがある。
処置
下記等の適切な処置を行うこと。
徐脈、完全房室ブロック:アトロピン硫酸塩水和物、イソプレナリン塩酸塩等の投与や心臓ペーシングを適用すること。
心不全の急性増悪:利尿薬、強心薬、血管拡張剤を静脈内投与すること。
低血圧:強心剤、昇圧剤、輸液等の投与や補助循環を適用すること。
気管支痙れん:イソプレナリン塩酸塩、β2刺激薬又はアミノフィリン水和物等の気管支拡張剤を投与すること。
適用上の注意
薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
その他の注意
臨床使用に基づく情報
β遮断剤服用中の患者では、他の薬剤によるアナフィラキシー反応がより重篤になることがあり、また、通常用量のアドレナリンによる治療では効果が得られない場合がある。
日本人慢性心不全患者を対象に、承認用法及び用量とは異なる用量調節方法(1日1回0.625、1.25、2.5又は5mgの段階で用量を増減)で実施されたプラセボ対照二重盲検比較試験では、主要評価項目である「心血管系の原因による死亡又は心不全悪化による入院」において本剤のプラセボに対する優越性は示されなかった[イベント発現例数:本剤群13/100例、プラセボ群14/100例、ハザード比(95%信頼区間):0.93(0.44-1.97)]。このうち「心不全悪化による入院」は本剤群12例、プラセボ群9例、「心血管系の原因による死亡」は本剤群1例、プラセボ群5例であった。
薬物動態
血中濃度
生物学的同等性試験
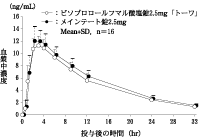
〈ビソプロロールフマル酸塩錠2.5mg「トーワ」〉
ビソプロロールフマル酸塩錠2.5mg「トーワ」とメインテート錠2.5mgを、クロスオーバー法によりそれぞれ1錠(ビソプロロールフマル酸塩として2.5mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
| 判定パラメータ | 参考パラメータ |
AUC0-32
(ng・hr/mL) | Cmax
(ng/mL) | Tmax
(hr) | T1/2
(hr) |
ビソプロロールフマル酸塩錠
2.5mg「トーワ」 | 160.0±19.9 | 11.61±1.52 | 2.75±0.78 | 9.31±1.39 |
メインテート錠2.5mg | 174.8±23.0 | 12.64±2.00 | 2.56±0.73 | 9.72±1.18 |
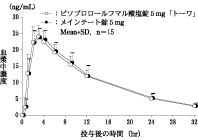
〈ビソプロロールフマル酸塩錠5mg「トーワ」〉
ビソプロロールフマル酸塩錠5mg「トーワ」とメインテート錠5mgを、クロスオーバー法によりそれぞれ1錠(ビソプロロールフマル酸塩として5mg)健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。
| 判定パラメータ | 参考パラメータ |
AUC0-32
(ng・hr/mL) | Cmax
(ng/mL) | Tmax
(hr) | T1/2
(hr) |
ビソプロロールフマル酸塩錠
5mg「トーワ」 | 337.2±52.8 | 24.68±3.35 | 2.87±0.64 | 9.28±1.19 |
メインテート錠5mg | 342.7±60.7 | 24.48±2.77 | 3.33±0.98 | 9.30±1.09 |
PharmacokineticsEtc
〈ビソプロロールフマル酸塩錠0.625mg「トーワ」〉
ビソプロロールフマル酸塩錠0.625mg「トーワ」は、ビソプロロールフマル酸塩錠2.5mg「トーワ」を標準製剤としたとき、溶出挙動が同等と判断され、生物学的に同等とみなされた。
有効成分に関する理化学的知見
一般的名称
ビソプロロールフマル酸塩(Bisoprolol Fumarate)
化学名
(2RS)-1-(4-{[2-(1-Methylethoxy)ethoxy]methyl}phenoxy)-3-[(1-methylethyl)amino]propan-2-ol hemifumarate
分子式
(C18H31NO4)2・C4H4O4
分子量
766.96
性状
白色の結晶又は結晶性の粉末である。水又はメタノールに極めて溶けやすく、エタノール(99.5)又は酢酸(100)に溶けやすい。水溶液(1→10)は旋光性を示さない。
化学構造式
融点
101~105℃
包装
〈ビソプロロールフマル酸塩錠0.625mg「トーワ」〉
100錠[10錠×10:PTP、乾燥剤入り]
300錠[バラ、乾燥剤入り]
〈ビソプロロールフマル酸塩錠2.5mg「トーワ」〉
100錠[10錠×10:PTP、乾燥剤入り]
500錠[10錠×50:PTP、乾燥剤入り]
〈ビソプロロールフマル酸塩錠5mg「トーワ」〉
100錠[10錠×10:PTP、乾燥剤入り]
500錠[10錠×50:PTP、乾燥剤入り]
300錠[バラ、乾燥剤入り]
主要文献
1
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:ビソプロロールフマル酸塩 慢性心不全の追加
2
社内資料:生物学的同等性試験(錠2.5mg)
3
社内資料:生物学的同等性試験(錠5mg)
4
社内資料:生物学的同等性試験(錠0.625mg)
文献請求先及び問い合わせ先
〒570-0081 大阪府守口市日吉町2丁目5番15号
製造販売業者等







 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379