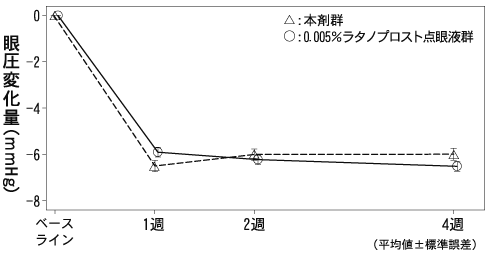
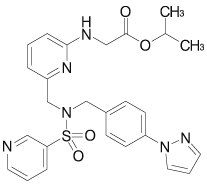
1
Aihara, M. et al.:J. Ocul. Pharmacol. Ther. 2019;35:542-550 〔66324〕
2
社内資料:サル眼組織分布(2018年9月21日承認、CTD2.6.4.4) 〔66033〕
3
社内資料:推定代謝経路(2018年9月21日承認、CTD2.6.4.5)〔66035〕
4
社内資料:代謝に関与する酵素(2018年9月21日承認、CTD2.6.4.5)〔66511〕
5
Aihara, M. et al.:Am. J. Ophthalmol. 2020;220:53-63 〔66405〕
6
Kirihara, T. et al.:Invest. Ophthalmol. Vis. Sci. 2018;59:145-153 〔66030〕
7
社内資料:受容体親和性及び選択性に関する試験(2018年9月21日承認、CTD2.6.2.2)〔66029〕
8
Fuwa, M. et al.:J. Ocul. Pharmacol. Ther. 2018;34:531-537 〔66031〕