1
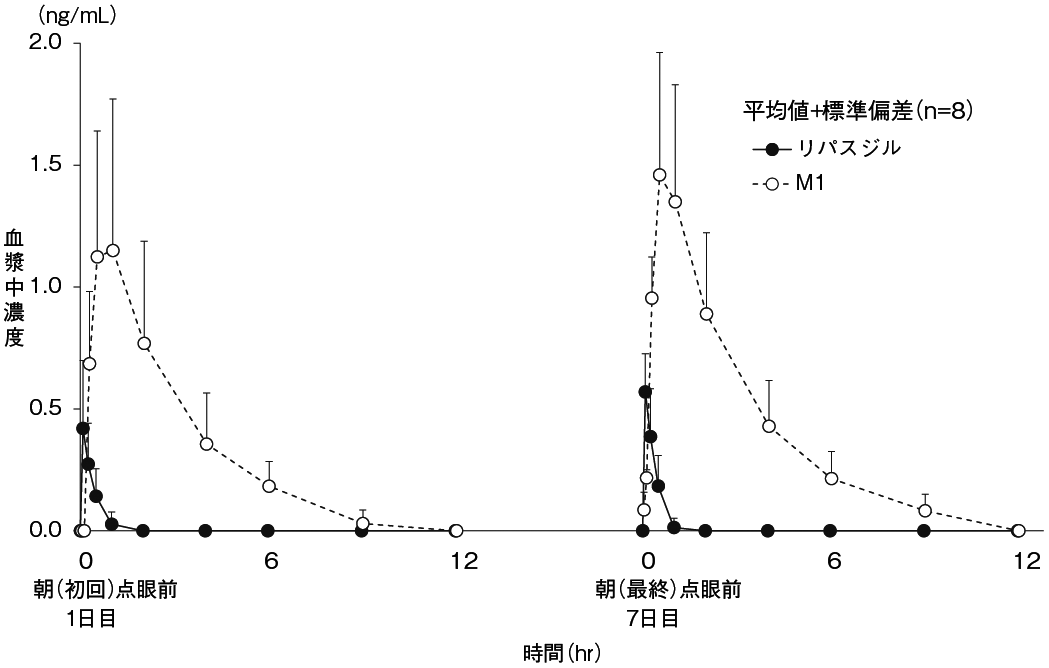
興和(株)社内資料: 第I相頻回・反復投与試験(2014年9月26日承認、CTD2.7.6.2)
2
興和(株)社内資料: 非臨床試験 薬物動態試験(2014年9月26日承認、CTD2.6.4.1-11)
3
興和(株)社内資料: 第I相単回投与試験(2014年9月26日承認、CTD2.7.6.1)
4
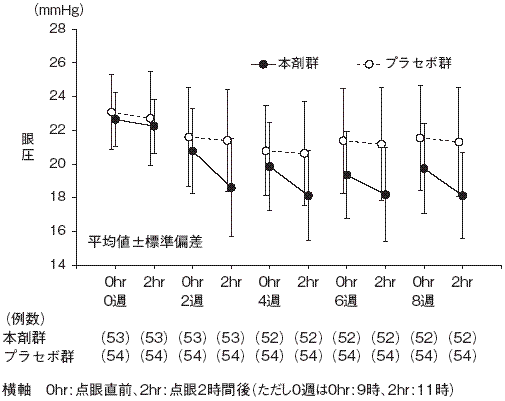
興和(株)社内資料: 第III相プラセボ対照二重盲検比較試験(2014年9月26日承認、CTD2.7.6.5)
5
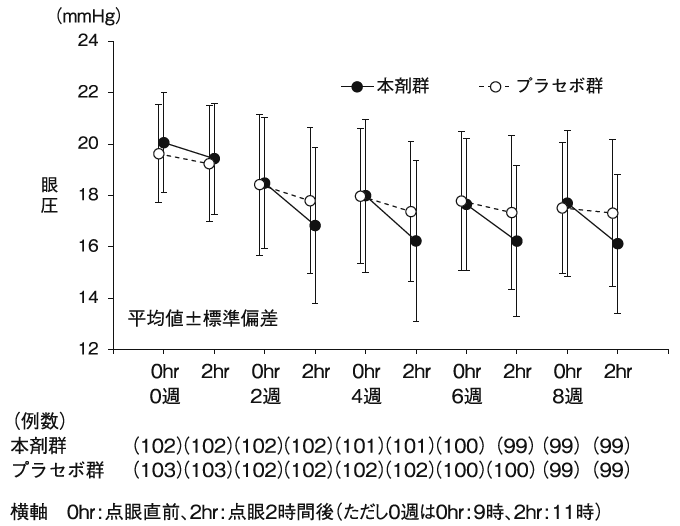
興和(株)社内資料: 第III相ラタノプロスト点眼液併用試験(2014年9月26日承認、CTD2.7.6.6)
6
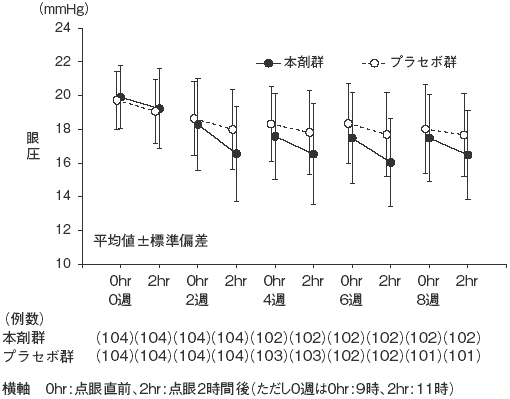
興和(株)社内資料: 第III相チモロール点眼液併用試験(2014年9月26日承認、CTD2.7.6.7)
7
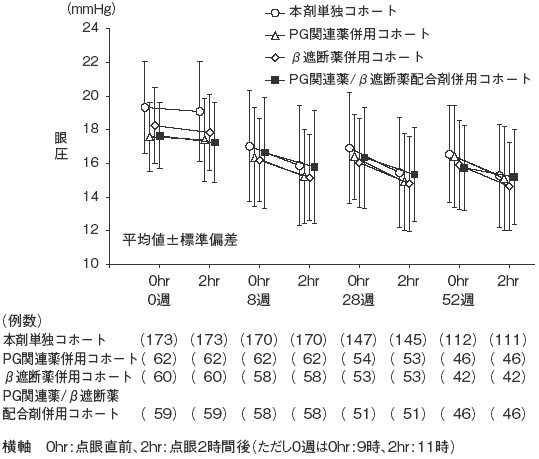
興和(株)社内資料: 第III相長期投与試験(2014年9月26日承認、CTD2.7.6.9)
8
興和(株)社内資料: 非臨床試験 薬理試験(2014年9月26日承認、CTD2.6.2.1-8)