1
マウス胚・胎児発生への影響に関する試験(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.6.6.6)
2
ラット出生前、出生後の発生並びに母体機能に関する試験(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.6.6.6)
3
ラットにおける乳汁排泄(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.6.4.6)
4
Herndon LW,et al.:Arch Ophthalmol,2002;120:847-849
5
Aihara M,et al.:Jpn J Ophthalmol,2011;55:600-604
6
ビマトプロスト点眼液の14日間反復点眼試験(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.7.6.2)
7
ビマトプロスト点眼液をサルに点眼後の眼組織中濃度(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.6.4.1、2.6.4.4)
8
健康成人における3H-ビマトプロストのマスバランス試験(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.7.6.7)
9
国内第Ⅲ相比較試験(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.7.6.4)
10
北澤克明 他:あたらしい眼科,2010;27:401-410
11
第Ⅲ相比較試験(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.7.6.5)
12
新家 眞 他:あたらしい眼科,2011;28:1209-1215
13
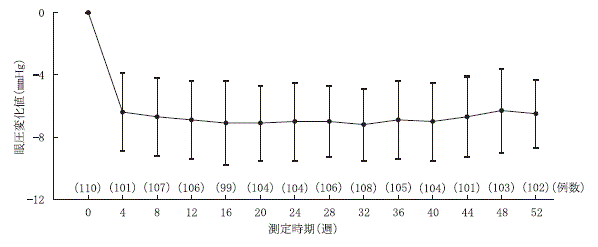
第Ⅲ相長期投与試験(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.7.6.6)
14
作用機序(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.4.2.1)
15
ビマトプロスト点眼液の眼圧下降作用に対するプロスタマイド拮抗剤の阻害作用(ルミガン点眼液0.03%:2009年7月7日承認、申請資料概要2.6.2.2)
16
Woodward DF,et al.:J Ophthalmol,2010;2010:926192
17
Woodward DF,et al.:J Pharmacol Exp Ther,2003;305:772-785