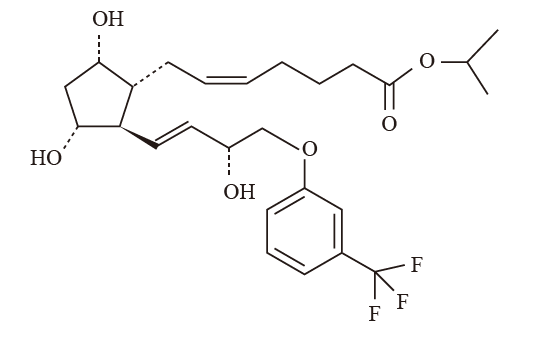
1
Nagasubramanian S,et al.:Ophthalmol.1993;100(9):1305-1311
2
Stjernschantz JW,et al.:Surv.Ophthalmol.2002;47(Suppl 1):S162-S175
3
出光俊郎ほか:臨床皮膚科.2002;56(5増刊):158-160
4
Maruyama K,et al.:J.Glaucoma.2014;23(3):160-163
5
社内資料:トラボプロスト点眼液0.004%「ニットー」の生物学的同等性試験