1
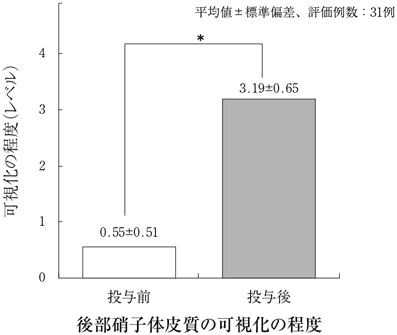
社内資料:硝子体手術時の硝子体可視化 第Ⅲ相試験(2010年10月27日承認、CTD2.7.6-2)
2
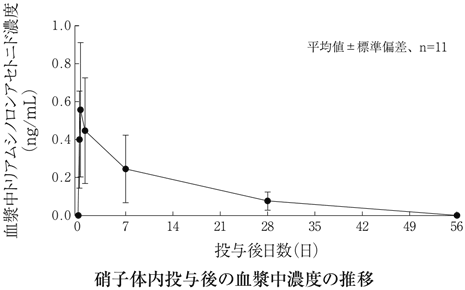
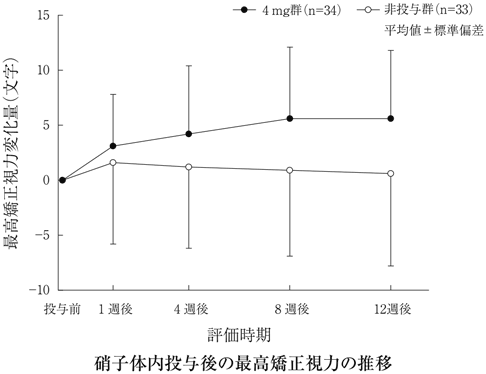
社内資料:糖尿病黄斑浮腫(硝子体内投与)第Ⅰ/Ⅱ相試験(2012年11月21日承認、CTD2.7.2.2)
3
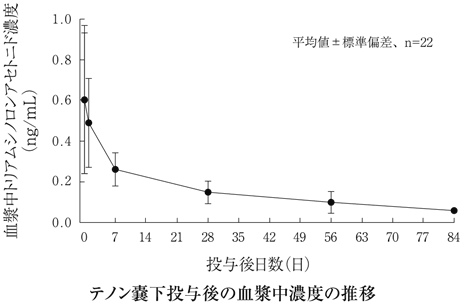
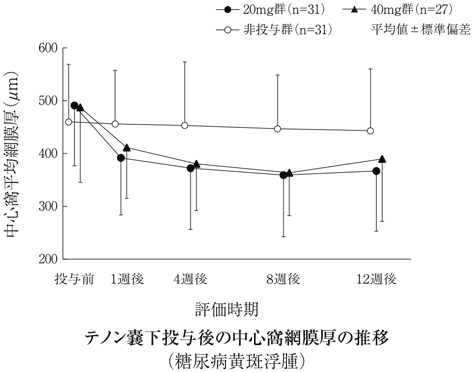
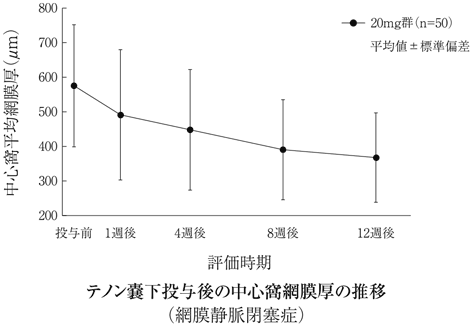
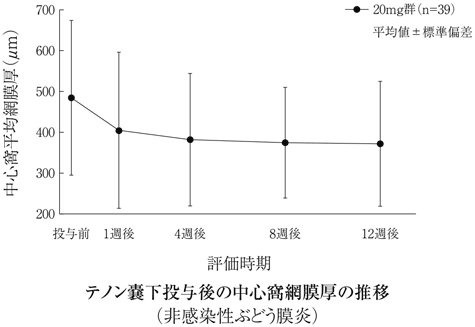
社内資料:糖尿病黄斑浮腫(テノン嚢下投与)第Ⅱ/Ⅲ相試験(2017年3月2日承認、CTD2.7.6.1)
4
社内資料:白色ウサギにおける眼内残存量の評価(2010年10月27日承認、CTD2.6.4.4)
5
社内資料:白色ウサギにおける眼組織及び血中移行性評価(2010年10月27日承認、CTD2.6.4.4)
6
社内資料:白色ウサギにおけるテノン嚢下投与後の血漿及び眼組織移行性評価(2017年3月2日承認、CTD2.6.4.4)
7
社内資料:in vitroメラニン親和性評価(2010年10月27日承認、CTD2.6.4.4)
8
小椋祐一郎 他:あたらしい眼科. 2014;31:1876-1884
9
Ogura Y, et al.:Ophthalmologica. 2018;DOI:10.1159/00492135
10
小椋祐一郎 他:あたらしい眼科. 2018;35:1418-1426
11
後藤 浩 他:あたらしい眼科. 2018;35:552-559
12
坂本泰二:日本の眼科. 2005;76:1315-1319
13
第十八改正日本薬局方解説書. 廣川書店,2021;C3631-C3636
14
社内資料:豚硝子体可視化試験(2010年10月27日承認、CTD2.6.2.2)
15
社内資料:LPS誘発RAW264.7細胞からのPGE2及びTNF-α産生に対する効果(2012年11月21日承認、CTD2.6.2.2)
16
Juergens UR, et al.:Eur J Med Res. 2004;9:383-390
17
社内資料:糖尿病ラットモデルの硝子体中VEGF濃度に対する薬効評価(2012年11月21日承認、CTD2.6.2.2)
18
Kim YH, et al.:Life Sci. 2007;81:1167-1173
19
社内資料:ウサギConcanavalin A誘発眼内炎症モデルを用いた薬効評価(2012年11月21日承認、CTD2.6.2.2)
20
Edelman JL, et al.:Exp Eye Res. 2005;80:249-258