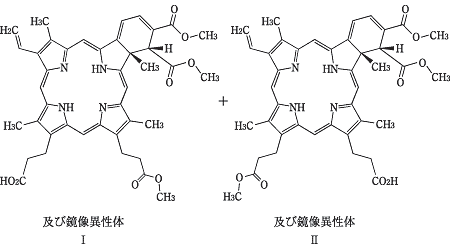
1
社内資料:第I相試験(2003年10月16日承認、申請資料概要 ヘ-37)
2
The Japanese Age-Related Macular Degeneration Trial(JAT)Study Group:Am. J. Ophthalmol.2003;136(6):1049-1061
3
Treatment of Age-Related Macular Degeneration withPhotodynamic Therapy(TAP)Study Group:Arch. Ophthalmol.2001;119(2):198-207
4
社内資料:第III相試験(2003年10月16日承認、申請資料概要 ト-116)
5
Verteporfin in Photodynamic Therapy Study Group:Am. J. Ophthalmol.2001;131(5):541-560
6
Miller, J. W. et al.:Arch. Ophthalmol.1999;117(9):1161-1173
7
Schmidt-Erfurth, U. et al.:Arch. Ophthalmol.1999;117(9):1177-1187
8
社内資料:VIO試験(Visudyne in Occult study)
9
Aveline, B. et al.:Photochem. Photobiol.1994;59(3):328-335
10
Fernandez, J. M. et al.:J. Photochem. Photobiol. B Biol.1997;37(1-2):131-140
11
Hadjur, C. et al.:Photochem. Photobiol.1997;65(5):818-827
12
Kramer, M. et al.:Ophthalmology.1996;103(3):427-438
13
Miller, J. W. et al.:Arch. Ophthalmol.1995;113(6):810-818
14
Schmidt-Erfurth, U. et al.:Lasers Surg. Med.1995;17(2):178-188