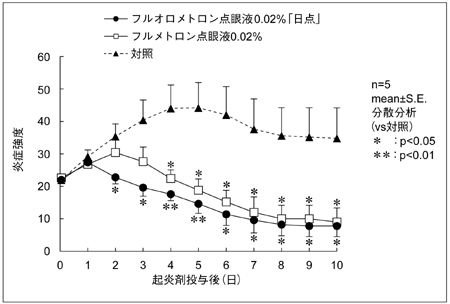
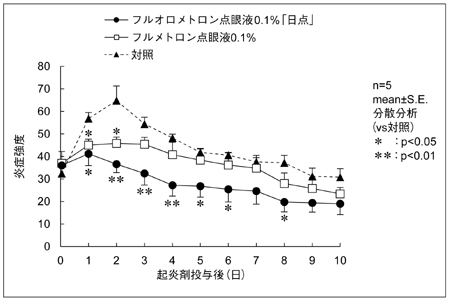
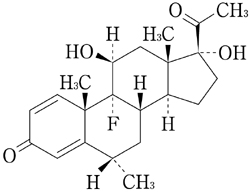
1
Yamauchi H, et al.:Jpn J Ophthalmol. 1975;19:339-347
2
石川哲 他:医学のあゆみ. 1974;88:442-449
3
小原博亨 他:日本眼科紀要. 1977;28:625-634
4
第十八改正日本薬局方解説書 廣川書店. 2021:C4848-C4851
5
第十八改正日本薬局方解説書 廣川書店. 2021:C4346-C4353
6
Grad HD, et al.:Ophthalmic Res. 1973;5:204-214
7
山内秀泰 他:日本眼科紀要. 1973;24:969-979
8
小原博亨 他:日本眼科紀要. 1977;28:619-624
9
社内資料:生物学的同等性試験Ⅰ
10
社内資料:生物学的同等性試験Ⅱ