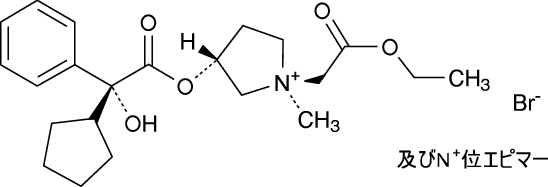
1
薬物動態試験(2020年9月25日承認、CTD2.6.4)
2
BBI-4000-08試験(2020年9月25日承認、CTD2.7.6.4)
3
BBI-4000-03試験(2020年9月25日承認、CTD2.7.6.2)
4
BBI-4000-06試験(2020年9月25日承認、CTD2.7.6.9)
5
BBI-4000-07試験(2020年9月25日承認、CTD2.7.6.10)
6
薬理試験(2020年9月25日承認、CTD2.6.2)
原発性腋窩多汗症治療剤
1g 242.6円
有効成分 | 1g中ソフピロニウム臭化物 50mg |
|---|---|
添加剤 | ヒドロキシプロピルセルロース、ヘキシレングリコール、ミリスチン酸イソプロピル、無水クエン酸、無水エタノール |
| 性状 | 無色~微黄色の澄明なゲル又は半透明なゲルである |
|---|
1%以上 | 1%未満 | |
|---|---|---|
適用部位 | 皮膚炎(6.4%)、紅斑(5.7%)、そう痒感、湿疹、刺激感注) | 汗疹 |
眼 | 散瞳、霧視注) | |
消化器 | 口渇 | |
泌尿器 | 排尿障害注) | |
その他 | ALT増加、AST増加、γ-GTP増加、好酸球百分率増加、代償性発汗注) |
Cmax (ng/mL) | Tmax (h) | AUC0-24 (ng・h/mL) | |
投与 2週目 | 0.17±0.27 (n=25) | 3.6±2.2 (n=12) | 2.2±3.7 (n=25) |
投与 4週目 | 0.14±0.30 (n=25) | 2.7±1.8 (n=11) | 1.6±4.0 (n=25) |
投与 6週目 | 0.098±0.17 (n=25) | 2.6±2.0 (n=11) | 0.87±1.8 (n=25) |