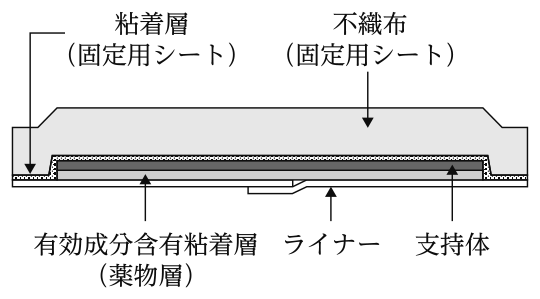
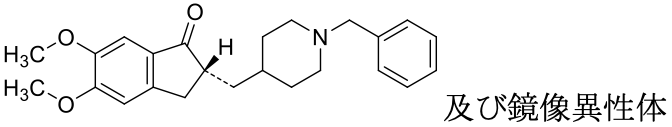
1
社内資料:相対バイオアベイラビリティ試験(2022年12月23日承認、CTD2.7.1.2.2)
2
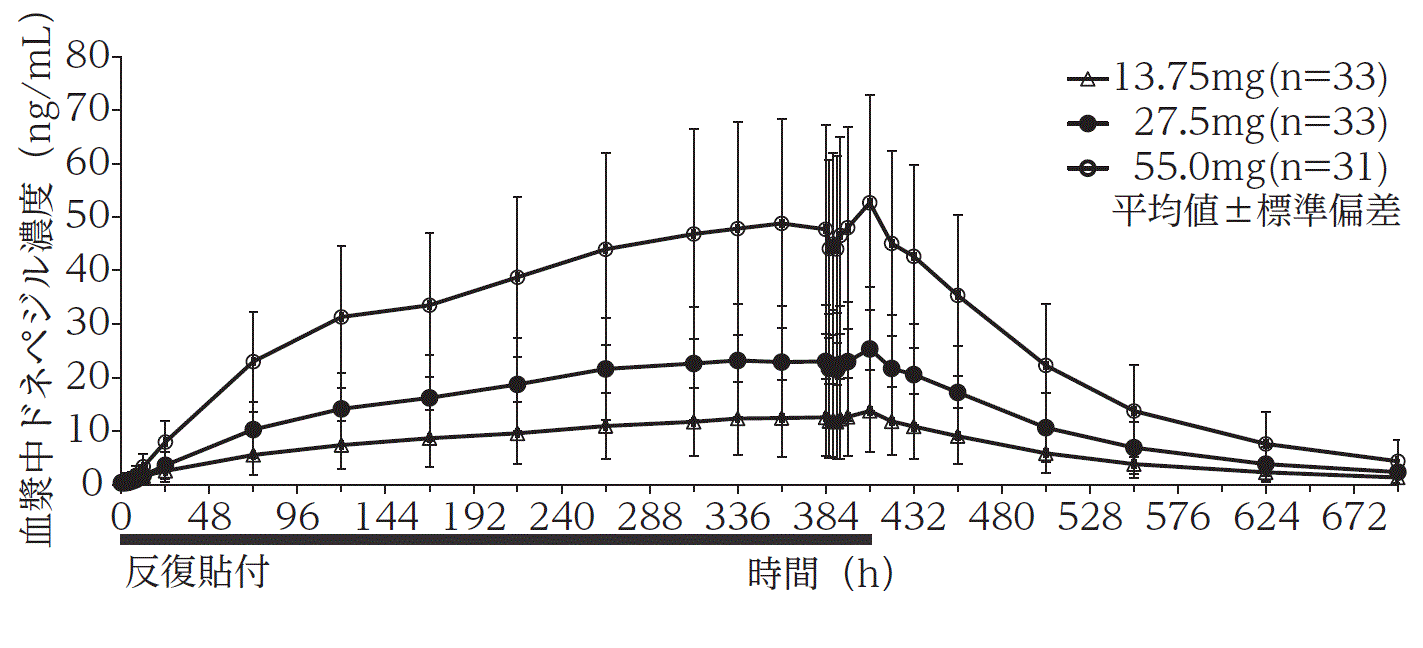
社内資料:用量比例性(2022年12月23日承認、CTD2.7.2.2.2.1)
3
社内資料:貼付部位検討試験(2022年12月23日承認、CTD2.7.2.2.2.2)
4
社内資料:ドネペジル塩酸塩の蛋白結合率(2022年12月23日承認、CTD2.7.2.3.2.2)
5
松井賢司ほか:薬物動態. 2000;15(2):101-111
6
社内資料:ドネペジル塩酸塩の経口投与時の排泄(2022年12月23日承認、CTD2.7.2.3.3.3)
7
Tiseo PJ, et al.:Br.J.Clin.Pharmacol. 1998;46(S.1):56-60
8
Tiseo PJ, et al.:Br.J.Clin.Pharmacol. 1998;46(S.1):51-55
9
社内資料:特定の背景を有する患者(2022年12月23日承認、CTD2.7.2.3.5)
10
社内資料:軽度及び中等度アルツハイマー型認知症を対象とした非劣性試験及び継続投与試験(2022年12月23日承認、CTD2.7.3.3、2.7.4.2)
11
社内資料:高度アルツハイマー型認知症を対象とした長期投与試験(2022年12月23日承認、CTD2.7.3.3、2.7.4.2)
12
山西嘉晴ほか:薬理と治療. 1998;26(S):S1277-S1282
13
山西嘉晴ほか:薬理と治療. 1998;26(S):S1283-S1294
14
小笹貴史ほか:薬理と治療. 1998;26(S):S1303-S1311
15
小倉博雄ほか:薬理と治療. 1998;26(S):S1313-S1320
16
社内資料:イボテン酸注入学習障害モデルラットに対する効力を裏付ける試験(2022年12月23日承認、CTD2.6.2.2.1)