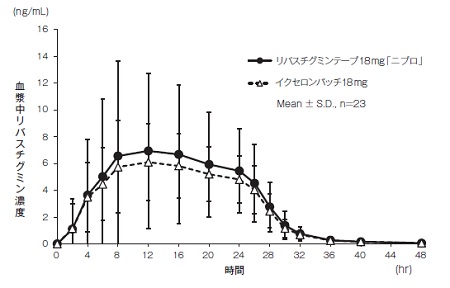
1
社内資料:生物学的同等性試験(テープ18mg)
2
肝機能障害を有する被験者を対象とした経口投与時の薬物動態(イクセロンパッチ・リバスタッチパッチ:2011年4月22日承認、CTD2.7.2.2.2.2.1)(L20210342)
3
社内資料:放出試験
4
薬理試験の概要文、考察及び結論(イクセロンパッチ・リバスタッチパッチ:2011年4月22日承認、CTD2.6.2.6)(L20230987)
アルツハイマー型認知症治療剤
1枚 103.9円
有効成分 | 1枚中リバスチグミン 4.5mg |
|---|---|
添加剤 | アクリル酸2-エチルヘキシル・アクリル酸ブチル・ジアセトンアクリルアミド共重合体溶液 |
有効成分 | 1枚中リバスチグミン 9mg |
|---|---|
添加剤 | アクリル酸2-エチルヘキシル・アクリル酸ブチル・ジアセトンアクリルアミド共重合体溶液 |
有効成分 | 1枚中リバスチグミン 13.5mg |
|---|---|
添加剤 | アクリル酸2-エチルヘキシル・アクリル酸ブチル・ジアセトンアクリルアミド共重合体溶液 |
有効成分 | 1枚中リバスチグミン 18mg |
|---|---|
添加剤 | アクリル酸2-エチルヘキシル・アクリル酸ブチル・ジアセトンアクリルアミド共重合体溶液 |
| 外形 |  |
|---|---|
| 大きさ | 16mm×16mm(2.5cm2) |
| 性状 | 無色半透明~淡黄色半透明の膏体を支持体に展延し、剥離ライナーに覆われた四隅が丸い四角形のテープ剤 |
| 外形 |  |
|---|---|
| 大きさ | 22.5mm×22.5mm(5cm2) |
| 性状 | 無色半透明~淡黄色半透明の膏体を支持体に展延し、剥離ライナーに覆われた四隅が丸い四角形のテープ剤 |
| 外形 |  |
|---|---|
| 大きさ | 27.7mm×27.7mm(7.5cm2) |
| 性状 | 無色半透明~淡黄色半透明の膏体を支持体に展延し、剥離ライナーに覆われた四隅が丸い四角形のテープ剤 |
| 外形 |  |
|---|---|
| 大きさ | 32mm×32mm(10cm2) |
| 性状 | 無色半透明~淡黄色半透明の膏体を支持体に展延し、剥離ライナーに覆われた四隅が丸い四角形のテープ剤 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
コリン作動薬 アセチルコリンカルプロニウムベタネコールアクラトニウム コリンエステラーゼ阻害剤 アンベノニウムジスチグミンピリドスチグミンネオスチグミン等 | コリン刺激作用が増強され、コリン系副作用(悪心、嘔吐、徐脈等)を引き起こす可能性がある。 | 本剤と同様にコリン作動性作用を有している。 |
抗コリン作用を有する薬剤 トリヘキシフェニジルピロヘプチンマザチコールメチキセンビペリデン等 アトロピン系抗コリン剤 ブチルスコポラミンアトロピン等 | 本剤と抗コリン作用を有する薬剤のそれぞれの効果が減弱する可能性がある。 | 本剤と抗コリン作用を有する薬剤の作用が相互に拮抗する。 |
サクシニルコリン系筋弛緩剤 スキサメトニウム等 | サクシニルコリン系筋弛緩剤の作用が過剰にあらわれるおそれがある。 | 本剤がコリンエステラーゼを阻害し、脱分極性筋弛緩剤の分解を抑制する。 |
非ステロイド性消炎鎮痛剤 | 胃潰瘍又は十二指腸潰瘍を誘発又は悪化させるおそれがある。 | コリン系の賦活により胃酸分泌量が増加する。 |
5%以上 | 1~5%未満 | 1%未満 | 頻度不明 | |
|---|---|---|---|---|
感染症 | - | - | 尿路感染 | - |
血液及びリンパ系障害 | - | - | 貧血、好酸球増加症 | - |
代謝及び栄養障害 | 食欲減退 | - | 糖尿病 | - |
精神障害 | - | - | 不眠症、うつ病、落ち着きのなさ | 不安、攻撃性、悪夢 |
神経系障害 | - | 浮動性めまい、頭痛 | 傾眠、振戦 | - |
心臓障害 | - | - | 上室性期外収縮、頻脈、心房細動 | - |
血管障害 | - | 高血圧 | - | - |
胃腸障害 | 嘔吐、悪心 | 下痢、腹痛、胃炎 | 消化不良 | 膵炎 |
皮膚及び皮下組織障害 | 接触性皮膚炎 | - | 発疹、湿疹、紅斑、そう痒症、多汗症、アレルギー性皮膚炎 | 蕁麻疹、水疱 |
腎及び尿路障害 | - | 血尿 | 頻尿、蛋白尿、尿失禁 | - |
全身障害 | - | - | 疲労、無力症、けん怠感 | - |
適用部位障害 | 適用部位紅斑、適用部位そう痒感、適用部位浮腫 | 適用部位皮膚剥脱、適用部位疼痛、適用部位亀裂、適用部位皮膚炎 | 適用部位反応、適用部位腫脹、適用部位刺激感 | 適用部位過敏反応 |
臨床検査 | - | 体重減少、血中アミラーゼ増加 | 肝機能検査異常、コリンエステラーゼ減少 | - |
その他 | - | - | 転倒・転落、末梢性浮腫 | 縮瞳 |
判定パラメータ | 参考パラメータ | |||
AUC0→48hr(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
155.49±123.99 | 7.74±6.88 | 15.48±5.02 | 4.34±2.74 | |
イクセロンパッチ18mg | 137.66±58.94 | 6.73±3.14 | 14.09±4.65 | 5.37±3.58 |