1
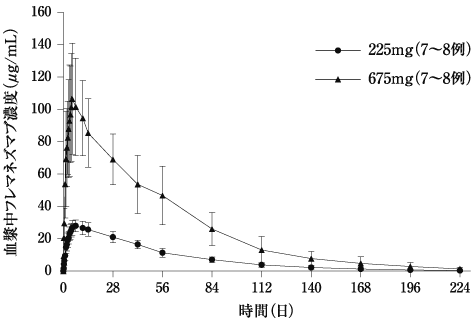
社内資料:健康成人における薬物動態試験(2021年6月23日承認、CTD2.7.6.2)
2
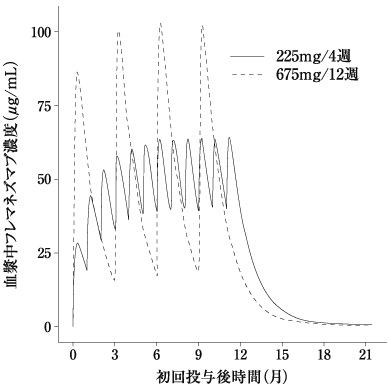
社内資料:母集団薬物動態解析(2021年6月23日承認、CTD2.7.2.3)
3
社内資料:反復性片頭痛患者を対象とした日韓二重盲検比較試験(2021年6月23日承認、CTD2.7.6.3)
4
社内資料:慢性片頭痛患者を対象とした日韓二重盲検比較試験(2021年6月23日承認、CTD2.7.6.3)
5
社内資料:反復性片頭痛患者を対象とした二重盲検比較試験(国際共同EM短期試験)(2021年6月23日承認、CTD2.7.6.3)
6
社内資料:慢性片頭痛患者を対象とした二重盲検比較試験(国際共同CM短期試験)(2021年6月23日承認、CTD2.7.6.3)
7
社内資料:片頭痛患者を対象とした日韓長期投与試験(2021年6月23日承認、CTD2.7.6.3)
8
Lassen, L. H. et al.:Cephalalgia.2002;22(1):54-61.
9
社内資料:In vitro機能性評価試験(2021年6月23日承認、CTD2.6.2.1)
10
社内資料:神経性血管拡張動物モデルにおける作用(2021年6月23日承認、CTD2.6.2.1)