1
社内資料: ガルカネズマブの毒性試験(2021年1月22日承認、CTD2.6.6)
2
社内資料: 日本人及び外国人健康被験者を対象としたガルカネズマブの第I相試験(2021年1月22日承認、CTD2.7.6.2)
3
Sakai F, et al.: Cephalalgia Rep. 2020; 3: 1-10
4
Hirata K, et al.: Expert Opin. Drug Saf. 2021; (doi: 10.1080/14740338.2021.1866536)
5
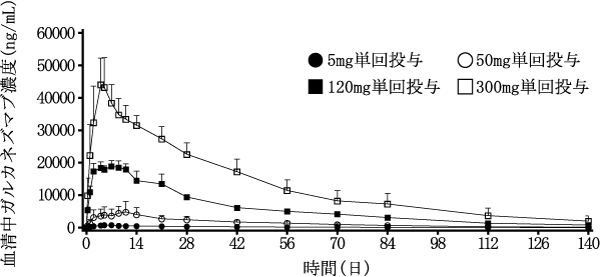
社内資料: ガルカネズマブの母集団薬物動態解析(2021年1月22日承認、CTD2.7.2.3、2.7.2.5)
6
Stauffer VL, et al.: Patient Prefer Adherence. 2018; 12: 1785-1795
7
Stauffer VL, et al.: JAMA Neurol. 2018; 75(9): 1080-1088
8
Skljarevski V, et al.: Cephalalgia. 2018; 38(8): 1442-1454
9
Detke HC, et al.: Neurology. 2018; 91(24): e2211-e2221
10
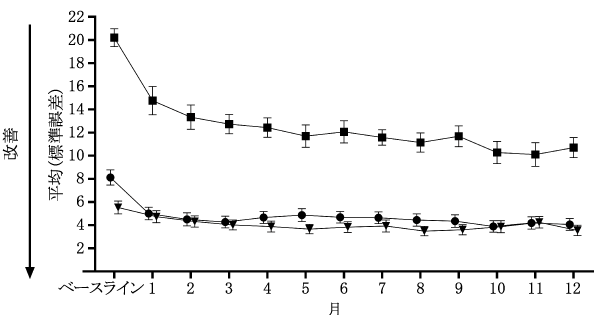
社内資料: 他剤で効果不十分な成人片頭痛患者を対象としたガルカネズマブの第III相無作為化二重盲検プラセボ対照試験(2021年1月22日承認、CTD2.7.6.7)
11
Mulleners WM, et al.: Lancet Neurol. 2020; 19(10): 814-825
12
社内資料: ガルカネズマブの薬理試験(2021年1月22日承認、CTD2.6.2)