1
社内資料:ウサギを用いた経口投与による胚・胎児発生に関する試験(2020年3月25日承認、申請資料概要4.2.3.5.2-3)
2
社内資料:ラットを用いた経口投与による出生前及び出生後の発生並びに母体の機能に関する試験(2020年3月25日承認、申請資料概要4.2.3.5.3-1)
3
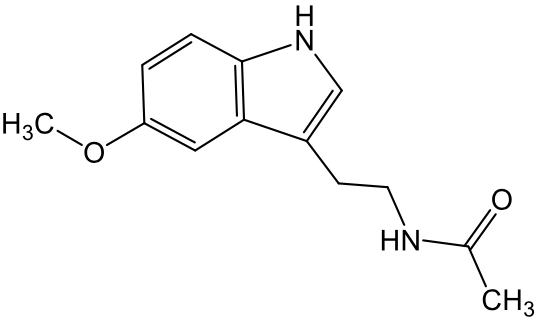
Reppert SM, et al.: Endocrinology. 1978; 102(2): 582-8
4
Härtter S, et al.: Clin Pharmacol Ther. 2000; 67(1): 1-6
5
Härtter S, et al.: Br J Clin Pharmacol. 2003; 56(6): 679-82
6
Ursing C, et al.: Eur J Clin Pharmacol. 2005; 61(3): 197-201
7
Kostoglou-Athanassiou I, et al.: Clin Endocrinol (Oxf). 1998; 48(1): 31-7
8
Terzolo M, et al.: Clin Endocrinol (Oxf). 1993; 39(2): 185-91
9
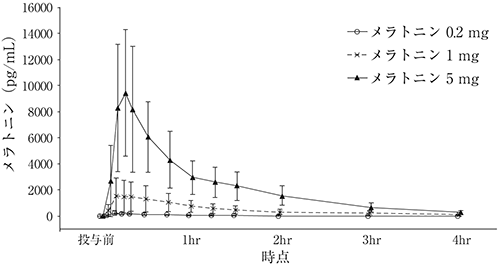
社内資料:第I相試験(2020年3月25日承認、申請資料概要5.3.3.1-1)
10
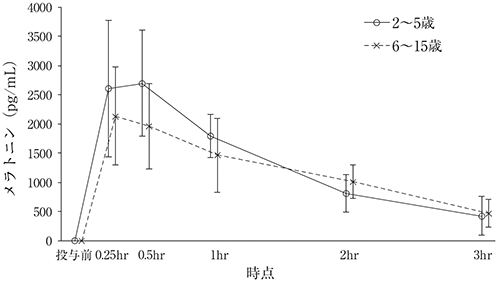
社内資料:臨床薬理試験(小児PK)(2020年3月25日承認、申請資料概要5.3.3.1-2)
11
Fourtillan JB, et al.: Biopharm Drug Dispos. 2000; 21(1): 15-22
12
Andersen LP, et al.: BMC Pharmacol Toxicol. 2016; 17: 8
13
DeMuro RL et al.: J Clin Pharmacol. 2000; 40(7): 781-4
14
Di WL, et al.: N Engl J Med. 1997; 336(14): 1028-9
15
Morin D, et al.: Pharmacology. 1997; 54(5): 271-5
16
Ma X, et al.: Drug Metab Dispos. 2005; 33(4): 489-94
17
Koch BC, et al.: Nephrol Dial Transplant. 2010; 25(2): 513-9
18
Chojnacki C, et al.: Pol Arch Med Wewn. 2012; 122(9): 392-6
19
Iguchi H, et al.: J Clin Endocrinol Metab. 1982; 54(5): 1025-7
20
社内資料:第II/III相試験(2020年3月25日承認、申請資料概要5.3.5.1-1)
21
社内資料:第III相試験(2020年3月25日承認、申請資料概要5.3.5.2-1)
22
Yukuhiro N, et al.: Brain Res. 2004; 1027(1-2): 59-66
23
Zhdanova IV, et al.: Physiol Behav. 2002; 75(4): 523-9