1
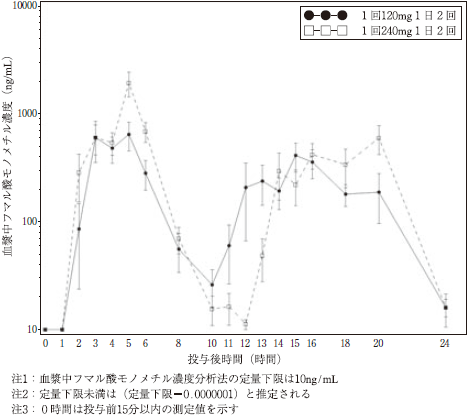
社内資料:フマル酸ジメチルの日本人を含む薬物動態試験成績(2016年12月19日承認、CTD2.7.6.3.3.1)
2
社内資料:フマル酸ジメチルの薬物動態試験成績(2016年12月19日承認、CTD2.7.6.3.2.1)
3
社内資料:インターフェロン ベータ-1aとの薬物相互作用試験成績(2016年12月19日承認、CTD2.7.6.3.4.1)
4
社内資料:グラチラマー酢酸塩との薬物相互作用試験成績(2016年12月19日承認、CTD2.7.6.3.4.2)
5
社内資料:エチニルエストラジオール-ノルゲスティメートとの薬物相互作用試験成績(2016年12月19日承認、CTD2.7.6.3.4.3)
6
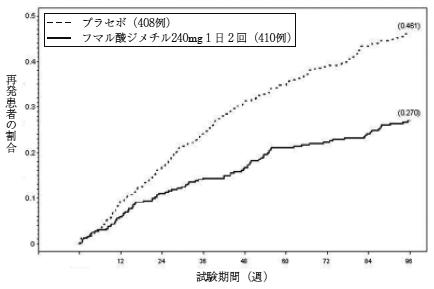
社内資料:フマル酸ジメチルの臨床試験成績(2016年12月19日承認、CTD2.7.6.5.1.4)
7
Gold R, et al. N Engl J Med. 2012; 367:1098-107
8
Fox RJ, et al. N Engl J Med. 2012; 367:1087-97
9
Linker RA, et al. Brain. 2011; 134:678-92
10
Kovac S, et al. Biochim Biophys Acta. 2015; 1850:794-801
11
Peng H, et al. J Biol Chem. 2012; 287:28017-26