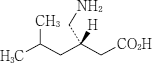
| 性状 | 白色の円形の素錠 |
|---|---|
| 大きさ | 直径:約6.1mm 厚さ:約3.2mm 重量:約80mg |
| 外形 |  |
| 識別コード | プレガバリンOD 25 KN |
| 性状 | 白色の円形の素錠 |
|---|---|
| 大きさ | 直径:約7.1mm 厚さ:約4.6mm 重量:約160mg |
| 外形 |  |
| 識別コード | プレガバリンOD 50 KN |
| 性状 | 白色の円形の素錠 |
|---|---|
| 大きさ | 直径:約8.4mm 厚さ:約5.2mm 重量:約240mg |
| 外形 |  |
| 識別コード | プレガバリンOD 75 KN |
| 性状 | 白色の円形の素錠 |
|---|---|
| 大きさ | 直径:約10.6mm 厚さ:約6.5mm 重量:約480mg |
| 外形 |  |
| 識別コード | プレガバリンOD 150 KN |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 中枢神経抑制剤 オピオイド系鎮痛剤 | 呼吸不全、昏睡がみられたとの報告がある。 | 機序不明 |
| オキシコドン ロラゼパム アルコール(飲酒) | 認知機能障害及び粗大運動機能障害に対して本剤が相加的に作用するおそれがある。 | 相加的な作用による |
| 血管浮腫を引き起こす薬剤(アンジオテンシン変換酵素阻害薬等) | 血管浮腫との関連性が示されている薬剤を服用している患者では、血管浮腫(顔面、口、頸部の腫脹など)を発症するリスクが高まるおそれがある。 | 機序不明 |
| 末梢性浮腫を引き起こす薬剤(チアゾリジン系薬剤等) | チアゾリジン系薬剤と本剤の併用により末梢性浮腫を発症するリスクが高まるおそれがある。また、チアゾリジン系薬剤は体重増加又は体液貯留を引き起こし、心不全が発症又は悪化することがあるため、本剤と併用する場合には慎重に投与すること。 | 機序不明 |
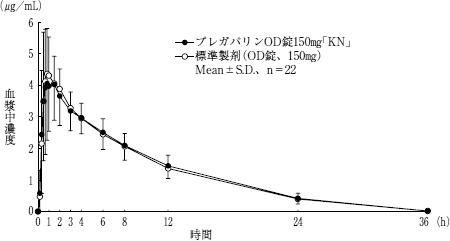
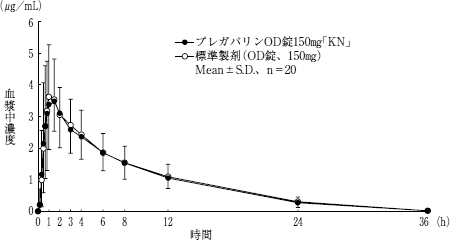
| 判定パラメータ | 判定パラメータ | 参考パラメータ | 参考パラメータ | ||
| AUC(0→36h) (μg・hr/mL) | Cmax (μg/mL) | tmax (h) | t1/2 (h) | ||
| 水あり | プレガバリンOD錠 150mg「KN」 | 44.11±8.95 | 5.12±1.58 | 1.5±1.0 | 6.5±0.8 |
| 水あり | 標準製剤 (OD錠、150mg) | 43.33±8.95 | 4.90±1.18 | 1.1±0.5 | 6.6±0.8 |
| 水なし | プレガバリンOD錠 150mg「KN」 | 33.01±10.33 | 4.10±1.33 | 1.3±0.5 | 6.6±0.8 |
| 水なし | 標準製剤 (OD錠、150mg) | 34.00±10.59 | 4.30±1.29 | 1.4±0.9 | 6.7±0.8 |