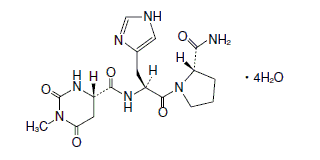
1
甲斐沼正 他:臨床医薬. 1997;13(10):2501-2516
2
甲斐沼正 他:臨床医薬. 1997;13(10):2517-2532
3
社内資料:生物学的同等性試験
4
藤田雅巳 他:臨床医薬. 1997;13(13):3359-3369
5
血漿蛋白結合(セレジスト錠:2000年7月3日承認、申請資料概要ヘ.Ⅱ.2.(5))
6
血漿、尿および胆汁代謝物(セレジスト錠:2000年7月3日承認、申請資料概要ヘ.Ⅱ.3.(2))
7
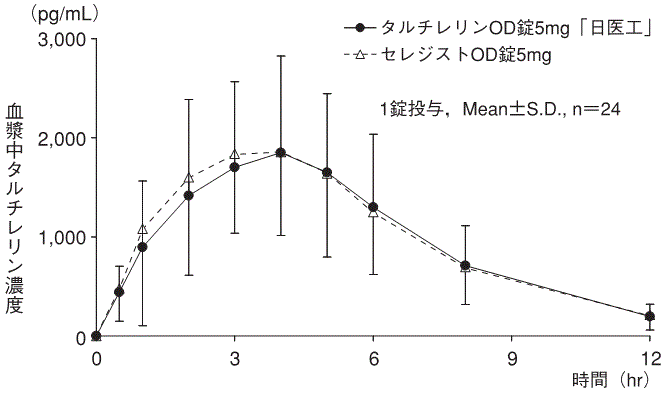
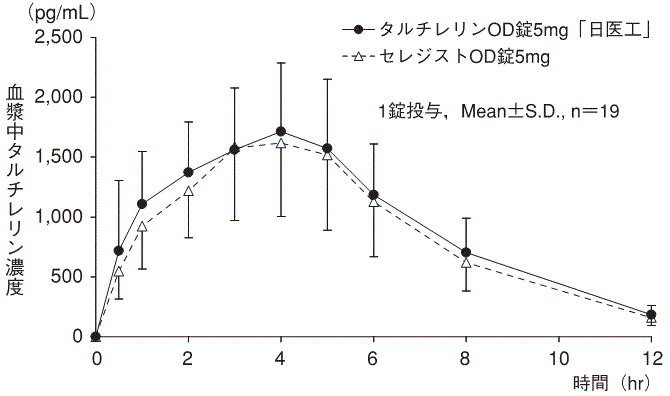
血漿中濃度(セレジスト錠:2000年7月3日承認、申請資料概要ヘ.Ⅲ.1.(1))
8
尿中への排泄(セレジスト錠:2000年7月3日承認、申請資料概要ヘ.Ⅲ.1.(2))
9
金澤一郎 他:臨床医薬. 1997;13(16):4169-4224
10
第Ⅲ相試験(セレジスト錠:2000年7月3日承認、申請資料概要ト.Ⅰ.3)
11
各種受容体およびイオンチャネルに対する結合阻害作用(セレジスト錠:2000年7月3日承認、申請資料概要ホ.Ⅰ.4.(1))
12
Kinoshita K., et al.:Jpn. J. Pharmacol. 1996;71(2):139-145
13
Fukuchi I., et al.:Arzneimittelforschung. 1998;48(4):353-359
14
Kinoshita K., et al.:Eur. J. Pharmacol. 1995;274(1-3):65-72
15
Kinoshita K., et al.: Br. J. Pharmacol. 1995;116(8):3274-3278
16
Kinoshita K., et al.:Eur. J. Pharmacol. 1998;343(2-3):129-133
17
亜急性及び慢性毒性試験(セレジスト錠:2000年7月3日承認、申請資料概要ニ.(総括))
18
Iwasaki Y., et al.:J. Neurol. Sci. 1992;112(1-2):147-151
19
Iwasaki Y., et al.:Neurol. Res. 1997;19(6):613-616
20
森安眞津子 他:日薬理誌. 1996;107(6):285-297
21
類薬から予想される薬理作用(内分泌系に対する作用)(セレジスト錠:2000年7月3日承認、申請資料概要ホ.Ⅱ.8)







 553
553 553
553