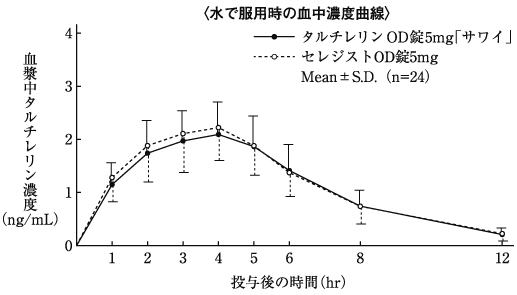
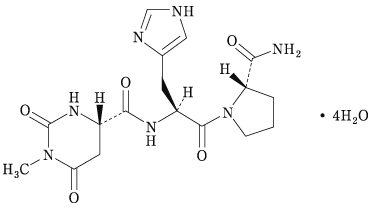
1
甲斐沼正他:臨床医薬, 1997;13(10):2501-2516
2
甲斐沼正他:臨床医薬, 1997;13(10):2517-2532
3
陶易王他:診療と新薬, 2012;49(3):319-326
4
髙野和彦他:新薬と臨床, 2016;65(4):461-471
5
藤田雅巳他:臨床医薬, 1997;13(13):3359-3369
6
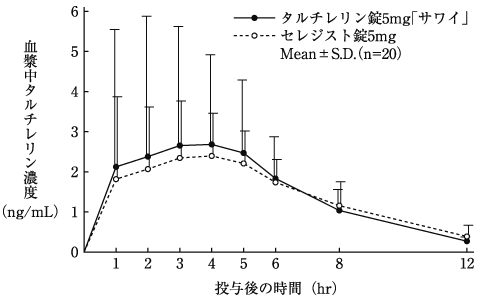
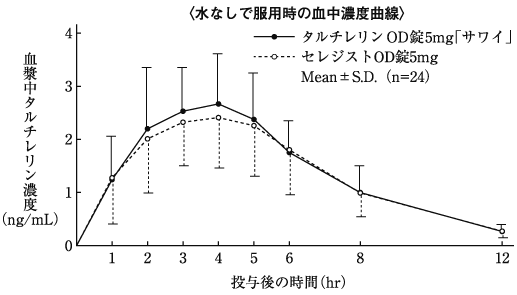
分布(セレジスト錠:2000年7月3日承認、申請資料概要ヘ.Ⅱ.2.(5))
7
代謝(セレジスト錠:2000年7月3日承認、申請資料概要ヘ.Ⅲ.1.(1))
8
金澤一郎他:臨床医薬, 1997;13(16):4169-4224
9
国内第Ⅲ相試験(セレジスト錠:2000年7月3日承認、申請資料概要ト.Ⅰ.3)
10
作用機序(セレジスト錠:2000年7月3日承認、申請資料概要ホ.Ⅳ)
11
Kinoshita, K. et al.:Jpn. J. Pharmacol., 1996;71(2):139-145
12
Fukuchi, I. et al.:Arzneimittelforschung, 1998;48(4):353-359
13
Kinoshita, K. et al.:Eur. J. Pharmacol., 1995;274(1-3):65-72
14
Kinoshita, K. et al.:Br. J. Pharmacol., 1995;116(8):3274-3278
15
Kinoshita, K. et al.:Eur. J. Pharmacol., 1998;343(2-3):129-133
16
運動失調改善作用(セレジスト錠:2000年7月3日承認、申請資料概要ニ.Ⅲ.1)
17
Iwasaki, Y. et al.:J. Neurol. Sci., 1992;112(1-2):147-151
18
Iwasaki, Y. et al.:Neurol. Res., 1997;19(6):613-616
19
森安眞津子他:日薬理誌, 1996;107(6):285-297
20
下垂体-甲状腺ホルモン刺激作用(セレジスト錠:2000年7月3日承認、申請資料概要ホ.Ⅱ.8)