1
Sanderink,G-J.et al.:J.Pharmacol.Exp.Ther.1997;282(3):1465-1472
2
丁 宗鉄他:臨床医薬.1996;12(5):795-807
3
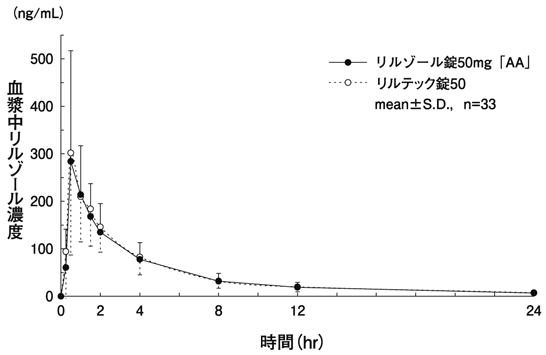
社内資料:生物学的同等性試験
4
丁 宗鉄他:臨床医薬.1996;12(5):809-827
5
Le Liboux,A.et al.:J.Clin.Pharmacol.1997;37(9):820-827
6
柳澤信夫他:医学のあゆみ.1997;182(11):851-866
7
特定使用成績調査(リルテック錠:2012年3月26日承認、再審査報告書)
8
Bensimon,G.et al.:N.Engl.J.Med.1994;330(9):585-591
9
Lacomblez,L.et al.:Lancet.1996;347(9013):1425-1431
10
使用成績調査の概要(リルテック錠:2012年3月26日承認、再審査報告書)
11
特定使用成績調査の概要(リルテック錠:2012年3月26日承認、再審査報告書)
12
Doble,A.:Rev.Contemp.Pharmacother.1997;8(4):213-225
13
Couratier,P.et al.:NeuroReport.1994;5(8):1012-1014
14
Gurney,M.E.et al.:Ann.Neurol.1996;39(2):147-157
15
Rothstein,J.D.et al.:J.Neurochem.1995;65(2):643-651
16
Estevez,A.G.et al.:Eur.J.Pharmacol.1995;280(1):47-53
17
Malgouris,C.et al.:Neurosci.Lett.1994;177(1-2):95-99