1
大川治他:基礎と臨床, 1984;18(10):5338-5356
2
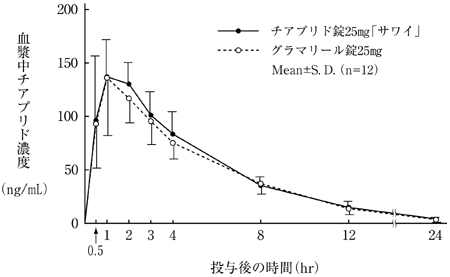
社内資料:生物学的同等性試験(錠25mg)
3
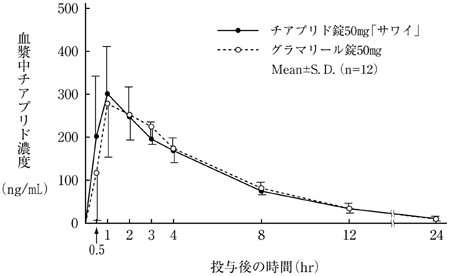
社内資料:生物学的同等性試験(錠50mg)
4
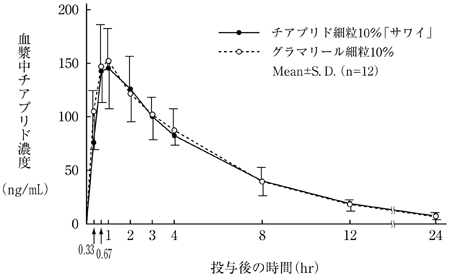
社内資料:生物学的同等性試験(細粒10%)
5
野口英世他:基礎と臨床, 1985;19(4):1977-1991
6
美川郁夫他:基礎と臨床, 1984;18(10):5357-5362
7
印東利勝他:基礎と臨床, 1984;18(11):5905-5912
8
本間昭他:新薬と臨床, 1985;34(1):17-26
9
大友英一他:臨床評価, 1985;13(2):295-332
10
黒岩義五郎他:臨床評価, 1984;12(1):137-194
11
佐藤壽他:診療と新薬, 1987;24(3):439-448
12
Arima, T. et al.:Jpn. J. Pharmacol., 1986;41(3):419-423
13
Chivers, J. K. et al.:Br. J. Pharmacol., 1983;79(Suppl.):398
14
Costall, B. et al.:Special Aspects of Psychopharmacology, 1983;41-48