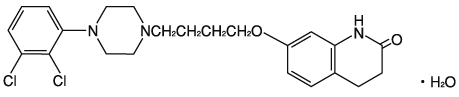
1
Schlotterbeck, P. et al.:Int J Neuropsychopharmacol.2007;10(3):433.
2
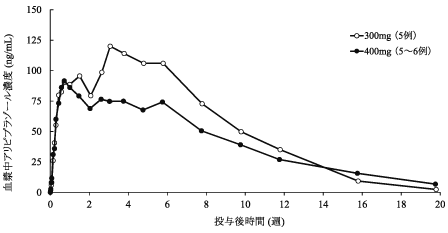
社内資料:単回筋肉内投与試験(2015年3月26日承認、CTD2.7.6.1)
3
社内資料:反復筋肉内投与試験(2015年3月26日承認、CTD2.7.6.1)
4
社内資料:反復三角筋内投与試験
5
社内資料:注射剤の母集団薬物動態解析2
6
社内資料:腎障害患者における薬物動態(2006年1月23日承認、CTD2.7.6.3)
7
社内資料:肝障害患者における薬物動態(2006年1月23日承認、CTD2.7.6.3)
8
社内資料:年齢、性別による影響(2006年1月23日承認、CTD2.7.6.3)
9
社内資料:母集団薬物動態及び薬力学解析(2006年1月23日承認、CTD2.7.6.3)
10
社内資料:キニジンとの相互作用(2006年1月23日承認、CTD2.7.6.3)
11
Azuma, J. et al.:Eur J Clin Pharmacol.2012;68(1):29-37.
12
Kubo, M. et al.:Drug Metab Pharmacokinet.2005;20(1):55-64.
13
社内資料:ケトコナゾールとの相互作用(2006年1月23日承認、CTD2.7.6.3)
14
社内資料:カルバマゼピンとの相互作用(2006年1月23日承認、CTD2.7.6.3)
15
社内資料:注射剤の統合失調症を対象とした臨床試験(2015年3月26日承認、CTD2.7.6.2)
16
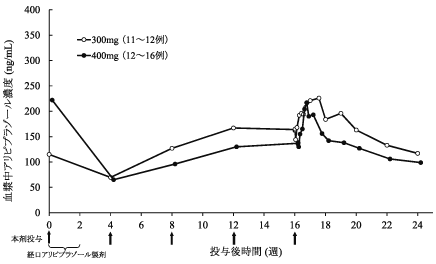
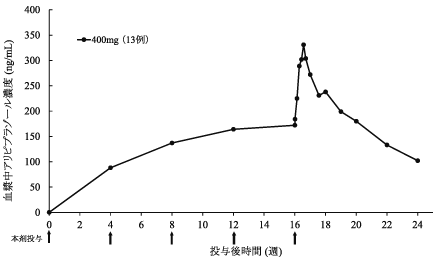
社内資料:注射剤の双極Ⅰ型障害患者を対象とした国際共同二重盲検試験(2020年9月25日承認、CTD2.7.6.1)
17
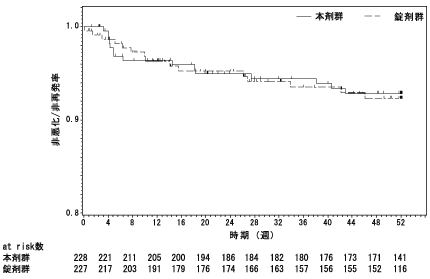
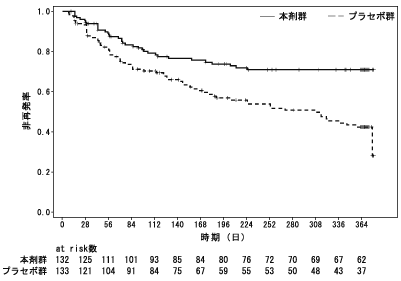
社内資料:注射剤の双極Ⅰ型障害患者を対象とした国際共同長期投与試験(2020年9月25日承認、CTD2.7.6.1)
18
Burris, K. D. et al.:J Pharmacol Exp Ther.2002;302(1):381-389.
19
Jordan, S. et al.:Eur J Pharmacol.2002;441(3):137-140.
20
Inoue, T. et al.:J Pharmacol Exp Ther.1996;277(1):137-143.
21
Kikuchi, T. et al.:J Pharmacol Exp Ther.1995;274(1):329-336.
22
Tadori, Y. et al.:Eur J Pharmacol.2008;597(1-3):27-33.
23
Hirose, T. et al.:J Psychopharmacol.2004;18(3):375-383.