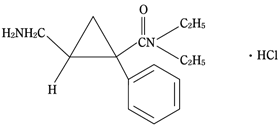
1
前田彰, 他:新薬と臨牀. 2008;57(6):952-969
2
Puozzo, C. et al.:Eur. J. Drug Metab. Pharmacokinet. 1998;23(2):280-286
3
Puozzo, C. et al.:Eur. J. Drug Metab. Pharmacokinet. 1998;23(2):273-279
4
中道昇, 他:臨床医薬. 1995;11(Suppl.3):133-143
5
社内資料:生物学的同等性試験(溶出挙動比較)
6
松原良次, 他:臨床医薬. 1995;11(4):819-842
7
遠藤俊吉, 他:臨床評価. 1995;23(1):39-64
8
北村佳久, 他:神経精神薬理. 1995;17(1):25-34
9
Mochizuki D. et al.:Psychopharmacology. 2002;162:323-332















 0120-041-189
0120-041-189

