1
相互作用に関する試験(ビ・シフロール錠:2003年10月16日承認、申請資料概要 ト.3.(6).3))
2
相互作用に関する試験(ビ・シフロール錠:2003年10月16日承認、申請資料概要 ヘ.3.(2))
3
母集団薬物動態解析(ミラペックスLA錠:2011年4月22日承認、申請資料概要 2.7.2.2.4)
4
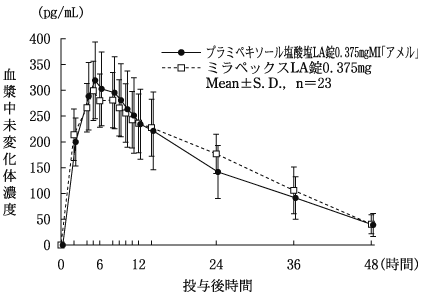
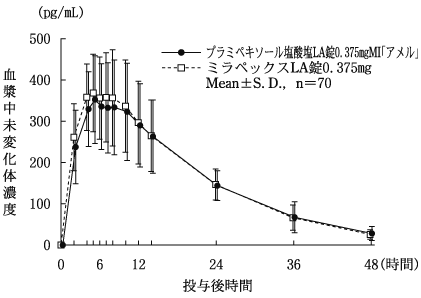
社内資料:生物学的同等性試験[LA錠0.375mg]
5
社内資料:生物学的同等性試験(溶出挙動比較)
6
国内二重盲検比較試験(ミラペックスLA錠:2011年4月22日承認、申請資料概要 2.7.6.8)
7
グッドマン・ギルマン薬理書 第12版. 廣川書店. 2013;780










 0120-041-189
0120-041-189

