1
Newport, D. J. et al.:Pediatrics, 2008;122:e223-231
2
厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
3
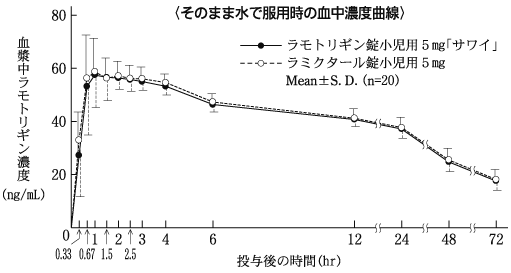
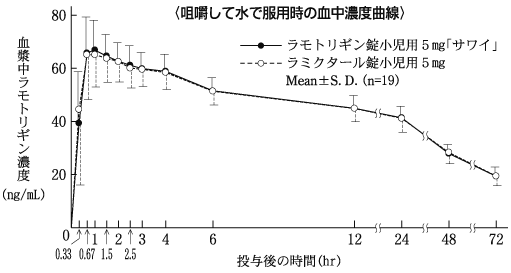
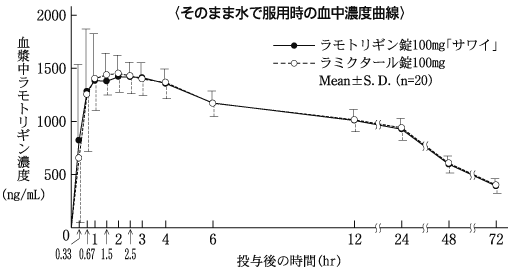
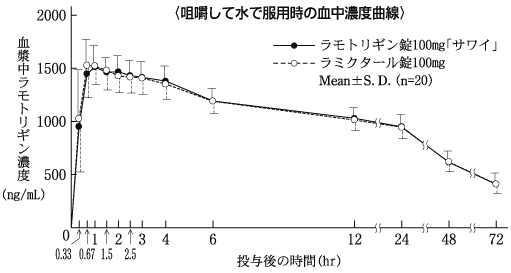
血中濃度(健康成人)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.2.2.2.1)
4
血中濃度(てんかん患者)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.2.2.2.2)
5
Jawad, S. et al.:Epilepsy Res., 1987;1:194-201
6
Anderson, G. D. et al.:Clin. Pharmacol. Ther., 1996;60:145-156
7
竹内譲他:新薬と臨床, 2018;67(4):429-445
8
髙野和彦他:新薬と臨床, 2018;67(4):417-427
9
食事の影響(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.1.1.2)
10
Yuen, W. C. et al.:Br. J. Clin. Pharmacol., 1988;26:242P
11
分布(ラミクタール錠:2008年10月16日承認、申請資料概要2.6.4.4.3)
12
Magdalou, J. et al.:J. Pharmacol. Exp. Ther., 1992;260:1166-1173
13
Green, M. D. et al.:Drug Metab. Dispos., 1995;23:299-302
14
代謝(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.2.2.1.7)
15
排泄(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.2.2.2.1.4)
16
Fillastre, J. P. et al.:Drugs Exp. Clin. Res., 1993;19:25-32
17
腎機能障害患者(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.2.2.2.3.3)
18
Marcellin, P. et al.:Br. J. Clin. Pharmacol., 2001;51:410-414
19
肝機能障害患者(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.2.2.2.3.1)
20
Posner, J. et al.:J. Pharm. Med., 1991;1:121-128
21
高齢者(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.2.3.5)
22
他剤との併用試験(バルプロ酸ナトリウム)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.2.1.7)
23
Ebert, U. et al.:Eur. J. Clin. Pharmacol., 2000;56:299-304
24
van der Lee, M. J. et al.:Clin. Pharmacol. Ther., 2006;80:159-168
25
Burger, D. M. et al.:Clin. Pharmacol. Ther., 2008;84:698-703
26
他剤との併用試験(リスペリドン)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.2.4.4)
27
他剤との併用試験(経口避妊薬)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.2.4.1)
28
他剤との併用試験(オランザピン)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.2.2.2.4.2, 2.7.6.2.4.2)
29
Levy, R. H. et al.:Ther. Drug Monit., 2005;27:193-198
30
Weintraub, D. et al.:Arch. Neurol., 2005;62:1432-1436
31
Doose, D. R. et al.:Epilepsia, 2003;44:917-922
32
Gidal, B. E. et al.:Epilepsy Res., 2005;64:1-11
33
Perucca, E. et al.:Epilepsy Res., 2003;53:47-56
34
Majid, O. et al.:Br. J. Clin. Pharmacol., 2016;82:422-430
35
Halász, P. et al.:Epilepsia, 2009;50:443-453
36
Brodie, M. J. et al.:Epilepsia, 2005;46:1407-1413
37
他剤との併用試験(リチウム)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.2.4.3)
38
Schieber, F. C. et al.:Hum. Psychopharmacol., 2009;24:145-152
39
In vitro試験(ラミクタール錠:2011年7月1日承認、申請資料概要2.7.4.6)
40
社内資料:生物学的同等性試験(錠25mg)
41
Yamamoto, T. et al.:Epilepsy & Seizure Journal of Japan Epilepsy Society, 2014;7:55-65
42
国際共同第Ⅲ相試験(成人、単剤療法)(ラミクタール錠:2014年8月29日承認、審査報告書)
43
Yasumoto, S. et al.:Brain Dev., 2016;38:407-413
44
国際共同第Ⅲ相試験(小児、単剤療法)(ラミクタール錠:2015年9月24日承認、申請資料概要2.7.6 LAM115377試験)
45
Reunanen, M. et al.:Epilepsy Res., 1996;23:149-155
46
海外第Ⅲ相試験(小児及び成人、単剤療法)(ラミクタール錠:2014年8月29日承認、審査報告書)
47
村崎光邦他:臨床精神薬理, 2008;11:117-134
48
国内第Ⅲ相試験(成人、併用療法)①(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.3.1.2)
49
国内第Ⅲ相試験(成人、併用療法)②(ラミクタール錠:2008年10月16日承認、審査報告書)
50
大田原俊輔他:てんかん研究, 2008;25:425-440
51
国内第Ⅲ相試験(小児、併用療法)(ラミクタール錠:2008年10月16日承認、審査報告書)
52
Messenheimer, J. et al.:Epilepsia, 1994;35:113-121
53
Schapel, G. J. et al.:J. Neurol. Neurosurg. Psychiatry, 1993;56:448-453
54
海外臨床試験(成人、併用療法)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.3.3.2.2.1, 2.7.6.3.1.5, 2.7.6.3.1.6)
55
Duchowny, M. et al.:Neurology, 1999;53:1724-1731
56
海外臨床試験(小児、併用療法)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.3.1.8)
57
Motte, J. et al.:N. Engl. J. Med., 1997;337:1807-1812
58
海外臨床試験(小児及び成人、併用療法)(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.3.1.9)
59
Biton, V. et al.:Neurology, 2005;65:1737-1743
60
小山司他:臨床精神医学, 2011;40:369-383
61
国内長期投与試験(成人)①(ラミクタール錠:2011年7月1日承認、申請資料概要2.7.4.7, 2.7.6 SCA106052試験)
62
国内長期投与試験(成人)②(ラミクタール錠:2011年7月1日承認、審査報告書)
63
厚生労働省医薬食品局:医薬品・医療機器等安全性情報, No.287(2012)
64
国内臨床試験における皮膚障害の発現率(ラミクタール錠:2008年10月16日承認、申請資料概要2.7.6.3.2.9)
65
国内臨床試験における皮膚粘膜眼症候群(Stevens-Johnson症候群)の発現率(ラミクタール錠:2008年10月16日承認、申請資料概要2.5.5.4)
66
Xie, X. et al.:Pflügers Arch., 1995;430:437-446
67
Leach, M. J. et al.:Epilepsia, 1986;27:490-497
68
Miller, A. A. et al.:Epilepsia, 1986;27:483-489
69
Cramer, C. L. et al.:Life Sci., 1994;54:PL271-275
70
Dalby, N. O. et al.:Epilepsy Res., 1997;28:63-72
71
Wheatley, P. L. et al.:Epilepsia, 1989;30:34-40
72
Otsuki, K. et al.:Epilepsy Res., 1998;31:101-112
73
Stratton, S. C. et al.:Epilepsy Res., 2003;53:95-106
74
De Sarro, G. et al.:Neuropharmacology, 1996;35:153-158
75
Smith, S. E. et al.:Epilepsy Res., 1993;15:101-111
76
Hosford, D. A. et al.:Epilepsia, 1997;38:408-414
77
遺伝的てんかんモデル動物での評価(ELマウス)(ラミクタール錠:2008年10月16日承認、申請資料概要2.6.2.2)