1
Fragen RJ, et al.:J Clin Anesth. 1999;11(6):466-470(L20201126)
2
Trissel LA, et al.:Int J Pharm Comp. 2002;6(3):230-233(L20201127)
3
第Ⅰ相試験(持続投与)(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.I.2.(1))(L20230428)
4
日本人及び欧米人の薬物動態に関する比較(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.III.1.(2))(L20230429)
5
血漿タンパクとの結合(プレセデックス静注液:2004年01月29日承認、申請資料概要ヘ.2.(2).3))(L20230430)
6
開発の経緯, 非臨床試験(プレセデックス静注液:2004年01月29日承認、申請資料概要イ.1.(2).1))(L20230431)
7
肝機能障害患者を対象とした試験(プレセデックス静注液:2004年01月29日承認、申請資料概要ヘ.3.(2).2))(L20230432)
8
代謝(プレセデックス静注液:2004年01月29日承認、申請資料概要ヘ.2.(3))(L20230433)
9
尿中及び糞中排泄物(プレセデックス静注液:2004年01月29日承認、申請資料概要ヘ.3.(1))(L20230434)
10
尿中代謝物(プレセデックス静注液:2004年01月29日承認、申請資料概要ヘ.2.(3).3))(L20230435)
11
使用上の注意(案)及びその設定根拠(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.IV.3)(L20230436)
12
Pugh RN, et al.:Br J Surg. 1973;60(8):646-649(L20201129)
13
肝機能障害例を対象とした試験(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.I.3.B)(L20230437)
14
腎機能障害例を対象とした試験(プレセデックス静注液:2004年01月29日承認、申請資料概要へ.3.(2).3))(L20230438)
15
腎機能障害例を対象とした試験(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.I.3.C)(L20230439)
16
高齢者を対象とした試験(プレセデックス静注液:2004年01月29日承認、申請資料概要へ.3.(2).1))(L20230440)
17
高齢者を対象とした試験(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.I.3.A)(L20230441)
18
相互作用(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.I.4)(L20230442)
19
第I相試験・日本人と欧米人の比較(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.III.1)(L20230443)
20
日本人を対象とした第Ⅱ/Ⅲ相ブリッジング試験(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.I.2.(2))(L20230444)
21
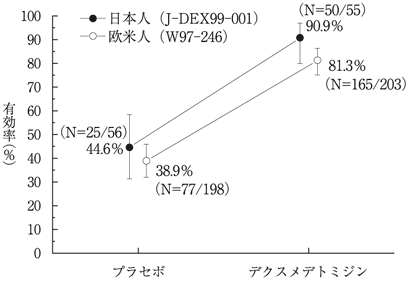
日本人及び欧米人患者における有効性と安全性に関する比較(プレセデックス静注液:2004年01月29日承認、申請資料概要ト.III.2)(L20230445)
22
国内長期投与臨床試験成績(プレセデックス静注液:2010年8月20日承認、審査報告書)(L20230446)
23
国内における局所浸潤・伝達麻酔等の局所麻酔下 非挿管手術・処置時鎮静試験(プレセデックス静注液:2013年06月14日承認、CTD2.7.6.2)(L20230447)
24
国内における硬膜外・脊髄くも膜下麻酔下 非挿管手術時鎮静試験(プレセデックス静注液:2013年06月14日承認、CTD2.7.6.3)(L20230448)
25
ラット鎮静作用機序(プレセデックス静注液:2004年01月29日承認、申請資料概要ホ.I.1.(2))(L20230449)
26
ラットα1及びα2受容体結合試験(プレセデックス静注液:2004年01月29日承認、申請資料概要ホ.I.1.(2))(L20230450)
27
Hunter JC, et al.:Br J Pharmacol. 1997;122(7):1339-1344(L20201131)
28
Bol CJJG, et al.:J Pharmacol Exp Ther. 1997;283(3):1051-1058(L20201132)
29
ラットにおける自発運動量の低下(プレセデックス静注液:2004年01月29日承認、申請資料概要ホ.I.1.(1).1))(L20230451)
30
ラットにおける正向反射の消失(プレセデックス静注液:2004年01月29日承認、申請資料概要ホ.I.1.(1).3))(L20230452)
31
Sabbe MB, et al.:Anesthesiology. 1994;80(5):1057-1072(L20201133)