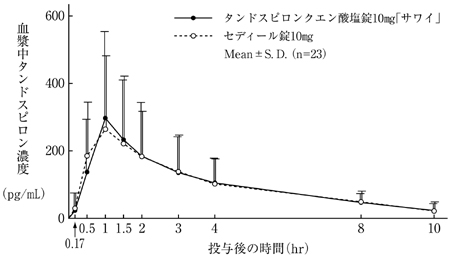
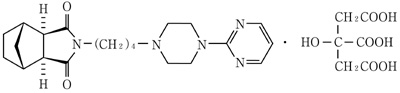
1
河南昇他:基礎と臨床, 1992;26:1803-1823
2
水野佳子他:基礎と臨床, 1992;26:1903-1945
3
中島光好他:基礎と臨床, 1992;26:4143-4165
4
筒井末春他:基礎と臨床, 1992;26:4252-4263
5
陶易王他:診療と新薬, 2008;45(5):482-492
6
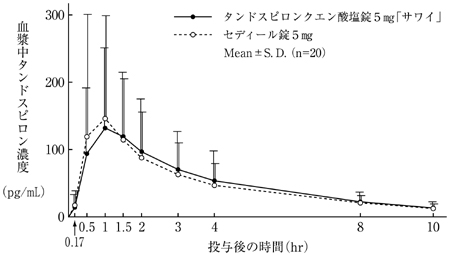
社内資料:生物学的同等性試験(錠20mg)
7
木村政資他:臨床評価, 1992;20:225-257
8
村崎光邦他:臨床評価, 1992;20:295-329
9
Shimizu, H. et al.:Jap. J. Pharmacol., 1988;46:311-314
10
清水宏志他:基礎と臨床, 1992;26:1681-1695
11
Shimizu, H. et al.:Jap. J. Pharmacol., 1992;58:283-289
12
Tatsuno, T. et al.:Pharmacol. Biochem. Behav., 1989;32:1049-1055
13
Wieland, S. et al.:Psychopharmacol., 1990;101:497-504
14
Tsuji, R. et al.:Arch. int. Pharmacodyn., 1991;311:131-143
15
原千高他:薬物・精神・行動, 1989;9:110
16
Shimizu, H. et al.:Jap. J. Pharmacol., 1987;45:493-500