1
河南昇 他:基礎と臨床. 1992;26:1803-1823
2
水野佳子 他:基礎と臨床. 1992;26:1903-1945
3
田中孝典 他:新薬と臨牀. 2008;57(6):936-951
4
社内資料:生物学的同等性試験(錠5mg)
5
社内資料:生物学的同等性試験(錠20mg)
6
清水宏志 他:Jap. J. Pharmacol. 1988;46:311-314
7
清水宏志 他:基礎と臨床. 1992;26:1681-1695
セロトニン作動性抗不安薬
1錠 6.3円
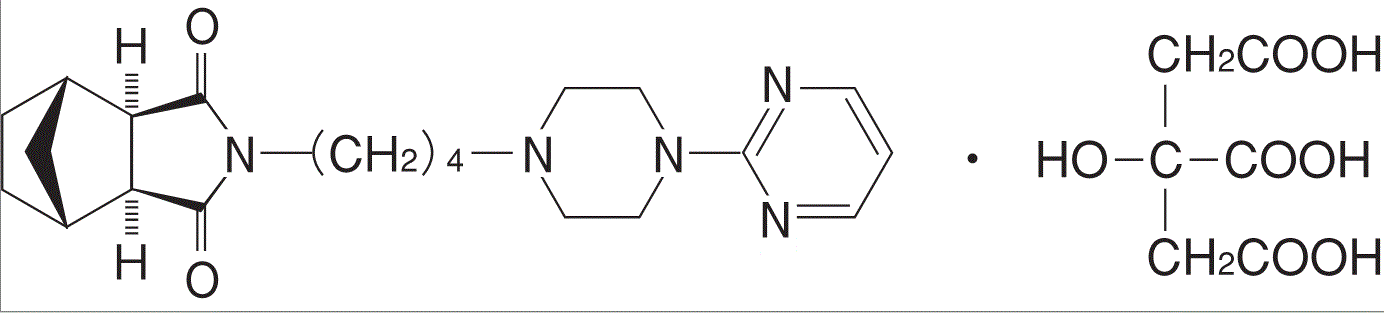
有効成分 | 1錠中 タンドスピロンクエン酸塩 5mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、結晶セルロース、カルメロースカルシウム、ヒプロメロース、ステアリン酸マグネシウム、ヒドロキシプロピルセルロース、酸化チタン、黄色三二酸化鉄、カルナウバロウ |
有効成分 | 1錠中 タンドスピロンクエン酸塩 10mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、結晶セルロース、カルメロースカルシウム、ヒプロメロース、ステアリン酸マグネシウム、ヒドロキシプロピルセルロース、酸化チタン、カルナウバロウ |
有効成分 | 1錠中 タンドスピロンクエン酸塩 20mg |
|---|---|
添加剤 | 乳糖水和物、トウモロコシデンプン、結晶セルロース、カルメロースカルシウム、ヒプロメロース、ステアリン酸マグネシウム、ヒドロキシプロピルセルロース、酸化チタン、カルナウバロウ |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 淡黄色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 6.2mm 大きさ(厚さ) 2.6mm |
| 質量 | 80mg |
| 本体表示 |  045 0455 |
| 本体コード |  045 045 |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 6.2mm 大きさ(厚さ) 2.6mm |
| 質量 | 80mg |
| 本体表示 |  046 04610 |
| 本体コード |  046 046 |
| 剤形 | 割線入りのフィルムコーティング錠 |
|---|---|
| 色調 | 白色~帯黄白色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 8.2mm 大きさ(厚さ) 3.1mm |
| 質量 | 158mg |
| 本体表示 |  047 04720 |
| 本体コード |  047 047 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ブチロフェノン系薬剤 ハロペリドール ブロムペリドール スピペロン 等 | 錐体外路症状を増強することがある。 | 本剤の弱い抗ドパミン作用が、ブチロフェノン系薬剤の作用を増強する。 |
カルシウム拮抗剤 ニカルジピン アムロジピン ニフェジピン 等 | 降圧作用を増強することがある。 | 本剤のセロトニン受容体を介した中枢性の血圧降下作用が降圧作用を増強する。 |
セロトニン再取り込み阻害作用を有する薬剤 フルボキサミン パロキセチン ミルナシプラン トラゾドン 等 | セロトニン症候群があらわれることがある。 | 併用により、セロトニン作用が増強するおそれがある。 |
1%以上 | 0.1~1%未満 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|---|
精神神経系 | 眠気 | めまい、ふらつき、頭痛、頭重、不眠 | 振戦、パーキンソン様症状 | 悪夢 |
肝臓 | AST、ALT、γ-GTPの上昇 | ALPの上昇 | ||
循環器系 | 動悸 | 頻脈、胸内苦悶 | ||
消化器系 | 悪心、食欲不振、口渇、腹部不快感、便秘 | 嘔吐、胃痛、胃のもたれ、腹部膨満感、下痢 | ||
過敏症 | 発疹、じん麻疹、そう痒感 | |||
その他 | 倦怠感、脱力感、気分不快、四肢のしびれ、目のかすみ | 悪寒、ほてり(顔面紅潮、灼熱感等)、多汗(発汗、寝汗等)、BUNの上昇、尿中NAGの上昇、好酸球増加、CKの上昇 | 浮腫 |
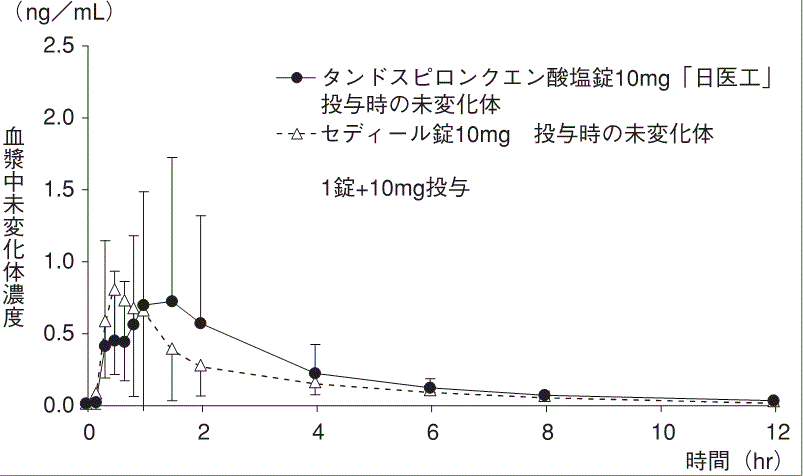
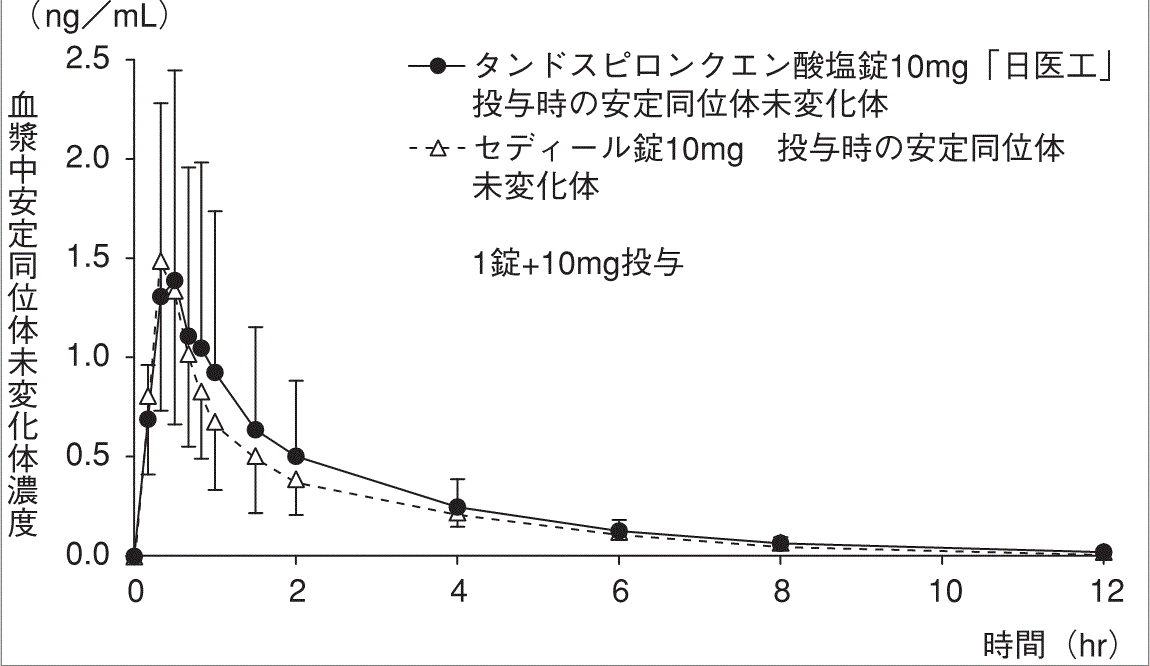
判定パラメータ | ||
r-AUC0→12注1) | r-Cmax注2) | |
タンドスピロンクエン酸塩錠 10mg「日医工」 | 0.6721±0.1935 | 0.6346±0.2367 |
セディ―ル錠10mg | 0.6260±0.1780 | 0.6329±0.2247 |