1
Cockayne DA. et al.:Blood., 1998;92(4):1324-33.
2
Sun L. et al.:FASEB J., 2003;17(3):369-75.
3
社内資料:国内第1/2相試験(TED14095)(2020年6月29日承認、CTD2.7.2.2)
4
社内資料:海外第1b相試験(TCD14079パートA)(2020年6月29日承認、CTD2.7.2.2)
5
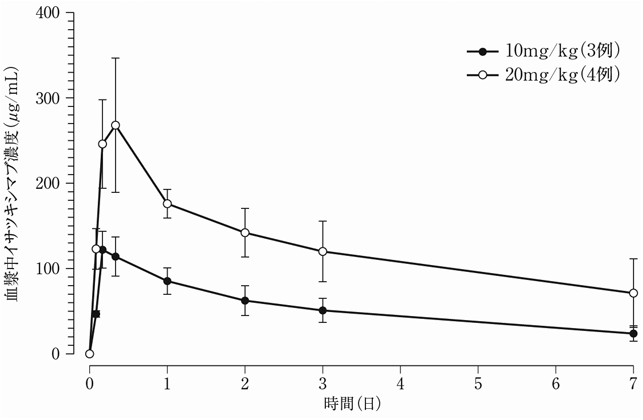
社内資料:母集団薬物動態解析(POH0503)(2020年6月29日承認、CTD2.7.2.2)
6
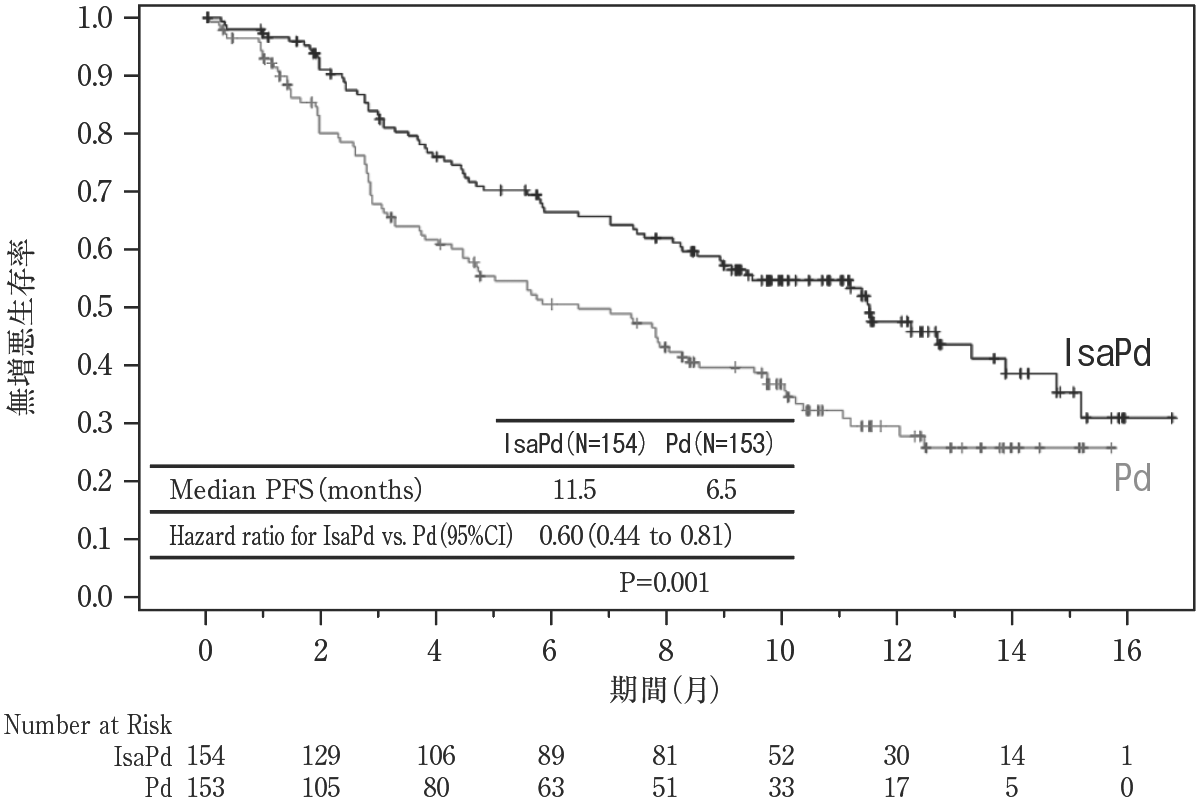
社内資料:国際共同第3相試験(EFC14335/ICARIA-MM)(2020年6月29日承認、CTD2.7.6.2)
7
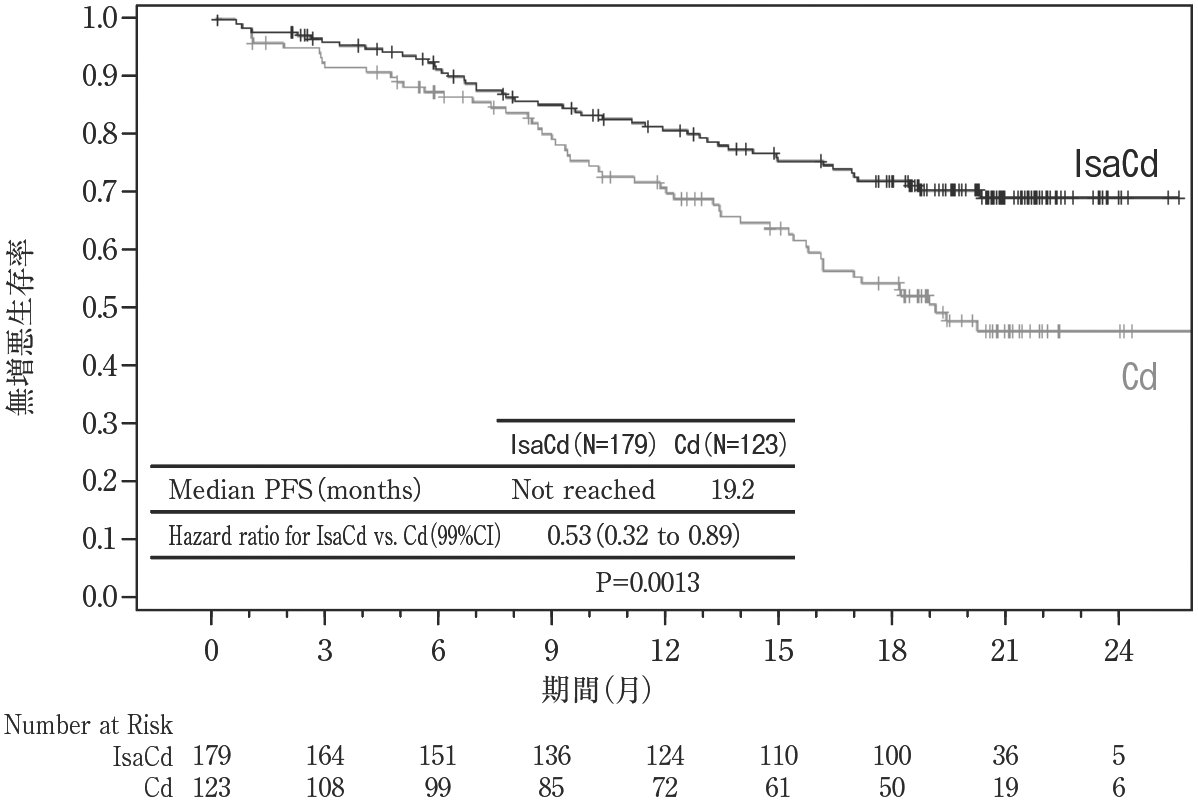
社内資料:国際共同第3相試験(EFC15246/IKEMA)(2021年11月承認、CTD2.7.6.2)
8
社内資料:海外第1/2相試験(TED10893)(2021年11月承認、CTD2.7.6.2)
9
社内資料:国内第1/2相試験(TED14095)(2021年11月承認、CTD2.7.6.2)
10
社内資料:非臨床薬効薬理試験(2020年6月29日承認、CTD2.6.2)
11
Deckert J. et al.:Clin Cancer Res., 2014;20:4574-83(doi:10.1158/1078-0432.CCR-14-0695)