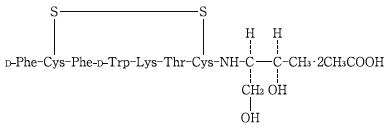
1
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:オクトレオチド酢酸塩(先天性高インスリン血症に伴う低血糖)
2
花村美帆ほか:日本病院薬剤師会雑誌 2010; 46(11):1501-1504
3
社内資料:配合変化試験
4
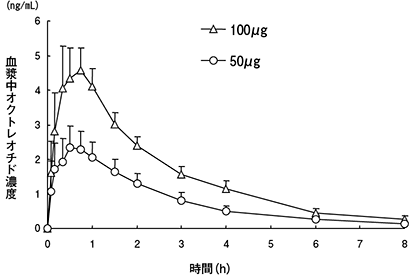
社内資料:日本人健康成人における薬物動態
5
社内資料:日本人健康成人における薬物動態
6
社内資料:外国人健康成人における薬物動態パラメータ
7
社内資料:外国人健康成人における薬物動態パラメータ
8
社内資料:日本人先端巨大症患者又は下垂体性巨人症患者における薬物動態
9
社内資料:消化管閉塞を伴う日本人進行・再発癌患者における薬物動態
10
社内資料:ヒトにおける血漿蛋白結合及び血球移行性
11
社内資料:外国人健康成人における尿中排泄率
12
社内資料:胆管挿管ラットにおける放射能及び未変化体の排泄
13
清野 裕ほか:ホルモンと臨床 1988; 36(6):581-590
14
島津 章ほか:日本内分泌学会雑誌 1989; 65(7):640-652
15
Shima,Y.et al.:Jpn.J.Clin.Oncol. 2008; 38(5):354-359
16
社内資料:進行・再発癌患者を対象とした第II相試験
17
Mercadante,S.et al.:Palliat Med. 1993; 7(4):295-299
18
Khoo,D.et al.:Eur.J.Cancer 1994; 30A(1):28-30
19
Mangili,G.et al.:Gynecol.Oncol. 1996; 61(3):345-348
20
前田征洋ほか:日本内科学会雑誌 1988; 77(1):86-90
21
吉岡光明ほか:日本内科学会雑誌 1988; 77(8):1276-1277
22
Kvols,L.K.et al.:N.Engl.J.Med. 1986; 315(11):663-666
23
福島英生ほか:日本内分泌学会雑誌 1988; 64(8):666-676
24
Lamberts,S.W.J.et al.:Clin.Endocrinol. 1987; 27(1):11-23
25
Miyachi,M.et al.:Biomed.Res. 1987; 8,Suppl.:65-70
26
Aurang,K.et al.:J.Pharmacol.Exp.Ther. 1997; 281(1):245-252
27
Verchere,C.B.et al.:Pharmacology 1993; 46(1):50-60
28
Misumi,A.et al.:Surgery 1988; 103(4):450-455
29
Nellgard,P.et al.:Scand.J.Gastroenterol. 1995; 30(5):464-469
30
Anthone,G.J.et al.:Surgery 1990; 108(6):1136-1142
31
Demura,N.et al.:Jpn.Pharmacol.Ther. 2010; 38(9):817-823
32
Pless,J.et al.:Scand.J.Gastroenterol. 1986; 21(S119):54-64