1
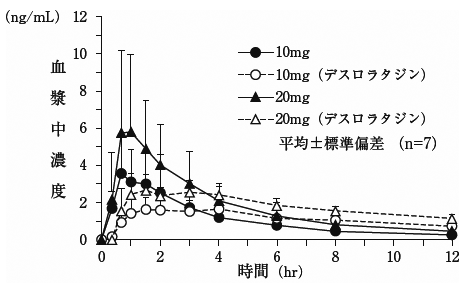
社内資料: 海外在住日本人健康被験者に対する反復経口投与時の薬物動態試験(2017年9月27日承認、CTD2.7.2.2)
2
社内資料: 健康被験者にルパタジンフマル酸塩を単回経口投与したときの中枢及び末梢作用並びに忍容性を評価する、無作為化、二重盲検、クロスオーバー比較試験(2017年9月27日承認、CTD2.7.4.5)
3
Vuurman E et al.: Hum Psychopharmacol. 2007; 22: 289.
4
牧野荘平. 日本アレルギー学会 アレルギー疾患治療ガイドライン. 95年改訂版. 1995; 96-97.
5
鼻アレルギー診療ガイドライン作成委員会. 鼻アレルギー診療ガイドライン-通年性鼻炎と花粉症-2016年版(改訂第8版). 2015; 68.
6
社内資料: 胚・胎児発生に関する試験(2017年9月27日承認、CTD2.6.6.6)
7
社内資料: ヒトCYP分子種発現系ミクロソームにおけるルパタジンの代謝試験(2017年9月27日承認、CTD2.7.2.2)
8
社内資料: ルパタジンのin vitro代謝に関与するCYPの研究(2017年9月27日承認、CTD2.7.2.2)
9
社内資料: 新生児(幼若動物)を用いた確認試験(2017年9月27日承認、CTD2.6.6.6)
10
社内資料: 健康被験者に空腹時又は非空腹時にルパタジンを単回経口投与したときの薬物動態を評価する試験(2017年9月27日承認、CTD2.7.2.2)
11
社内資料: ルパタジンのヒト血漿タンパク結合に関するin vitro及びex vivo試験(2017年9月27日承認、CTD2.7.2.2)
12
社内資料: 健康男性被験者に対する単回経口投与時の吸収、代謝及び排泄試験(2017年9月27日承認、CTD2.7.2.2)
13
社内資料: 健康高齢被験者及び健康若年被験者に対する反復経口投与時の薬物動態を評価する第I相、非盲検試験(2017年9月27日承認、CTD2.7.2.2)
14
社内資料: 健康被験者に対するグレープフルーツジュースとの相互作用を検討する非盲検、無作為、2群2期クロスオーバー試験(2017年9月27日承認、CTD2.7.2.2)
15
社内資料: 健康被験者にルパタジン及びエリスロマイシンを反復経口投与したときの薬物相互作用を評価する試験(2017年9月27日承認、CTD2.7.2.2)
16
社内資料: 健康被験者にルパタジン及びケトコナゾールを反復経口投与したときの薬物相互作用を評価する試験(2017年9月27日承認、CTD2.7.2.2)
17
社内資料: 季節性アレルギー性鼻炎患者を対象とした二重盲検比較試験(2017年9月27日承認、CTD2.7.3.2)
18
社内資料: 通年性アレルギー性鼻炎患者を対象とした長期投与試験(2017年9月27日承認、CTD2.7.3.2)
19
社内資料: 慢性蕁麻疹患者を対象とした二重盲検比較試験(2017年9月27日承認、CTD2.7.3.2)
20
社内資料: 皮膚疾患に伴うそう痒を対象とした長期投与試験(2017年9月27日承認、CTD2.7.3.2)
21
社内資料: ルパタジンのQT/QTc間隔への影響(2017年9月27日承認、CTD2.7.2.3)
22
社内資料: in vitro試験における抗ヒスタミン及び抗PAF作用(2017年9月27日承認、CTD2.6.2.1.1)
23
社内資料: in vivo試験における抗ヒスタミン及び抗PAF作用(2017年9月27日承認、CTD2.6.2.1.1)
24
社内資料: in vivo試験における抗アレルギー作用(2017年9月27日承認、CTD2.6.2.1.1)