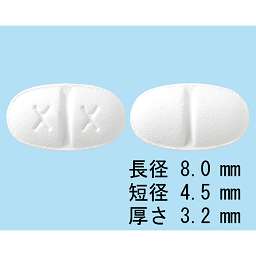
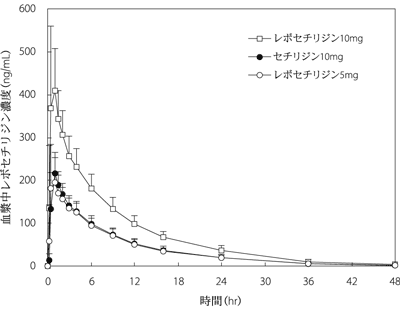
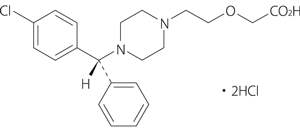
1
井野比呂子ほか:臨床薬理.2010;41:309-315
2
Benedetti MS, et al.:Eur J Clin Pharmacol.2001;57:571-582
3
奥田 稔ほか:耳鼻咽喉科展望.1994;37:754-779
4
奥田 稔ほか:耳鼻咽喉科展望.1995;38:116-136
5
斎藤博久:臨床医薬.2010;26:141-154
6
斎藤博久ほか:臨床医薬.2010;26:127-139
7
吉田彦太郎ほか:基礎と臨床.1994;28:2107-2129
8
吉田彦太郎ほか:基礎と臨床.1994;28:2131-2145
9
吉田彦太郎ほか:基礎と臨床.1994;28:2163-2173
10
社内資料:セチリジン円形錠(5mg錠)の慢性蕁麻疹に対する臨床試験
11
吉田彦太郎ほか:基礎と臨床.1994;28:2147-2162
12
中川秀己ほか:臨床医薬.2010;26:155-167
13
中川秀己ほか:臨床医薬.2010;26:169-181
14
Potter PC, et al.:Allergy.2003;58:893-899
15
Kapp A, et al.:Int J Dermatol.2006;45:469-474
16
社内資料:小児アレルギー性鼻炎を対象とした二重盲検比較試験(2009年4月22日承認、セチリジン塩酸塩CTD 2.7.6.3)
17
Gillard M,et al.:Mol Pharmacol.2002;61:391-399
18
Christophe B,et al.:Eur J Pharmacol.2003;470:87-94
19
Devalia JL,et al.:Allergy.2001;56:50-57
20
Thomson L,et al.:Clin Exp Allergy.2002;32:1187-1192