1
Ebert, A.D. et al.:J. Pediatr. Adolesc. Gynecol. 2017;30(5):560-567
2
第Ⅰ相試験-単回投与試験-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.6.3)
3
第Ⅰ相試験-反復投与試験-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.6.3)
4
第Ⅰ相試験-反復投与追加試験-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.6.3)
5
臨床薬物動態試験-子宮内膜症患者を対象とした母集団薬物動態解析-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.2.2)
6
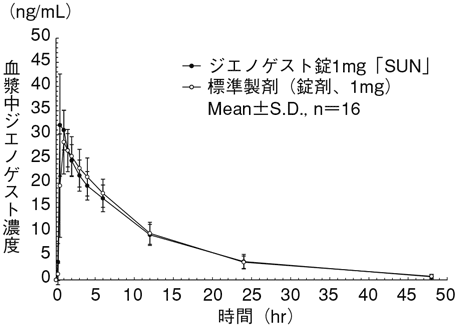
サンファーマ株式会社:社内資料(生物学的同等性試験)
7
海外臨床薬物動態試験-健康成人男性における生物学的利用率の検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.6.1)
8
薬物動態試験-ヒト血漿たん白結合(1)-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.4.4)
9
薬物動態試験-ヒト血漿たん白結合(2)-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.2.2)
10
薬物動態試験-代謝に関与するCYP分子種の検討(1)-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.4.5)
11
薬物動態試験-代謝に関与するCYP分子種の検討(2)-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.4.5)
12
薬物動態試験-CYP分子種に対する阻害作用の検討(1)-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.4.7)
13
薬物動態試験-CYP分子種に対する阻害作用の検討(2)-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.4.7)
14
臨床薬物動態試験-クラリスロマイシン併用の薬物相互作用-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.6.4)
15
原田 省 他:薬理と治療. 2008;36(2):129-140
16
長期投与試験-子宮内膜症患者における長期投与の有効性および安全性の検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.6.8)
17
全試験を通しての結果の比較と解析(ディナゲスト錠:2007年10月19日承認、申請資料概要2.7.3.3)
18
Osuga, Y. et al.:Fertil. Steril. 2017;108(4):673-678
19
Osuga, Y. et al.:J. Obstet. Gynaecol. Res. 2017;43(9):1441-1448
20
作用機序(ディナゲスト錠・OD 錠:2016 年12月2日承認、申請資料概要2.6.2)
21
薬理試験-ヒトプロゲステロン・アンドロゲンおよびグルココルチコイド受容体に対するアゴニスト活性の検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)
22
薬理試験-ヒトエストロゲン受容体に対するアゴニスト活性の検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)
23
薬理試験-ヒトミネラルコルチコイド受容体に対するアゴニスト活性およびアンタゴニスト活性の検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)
24
薬理試験-ヒトアンドロゲンおよびグルココルチコイド受容体に対するアンタゴニスト活性の検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)
25
薬理試験-エストロゲンを投与したラットの子宮重量増加に及ぼす影響-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)
26
薬理試験-エストロゲンを投与したラットにおける子宮重量増加抑制作用の機序検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)
27
薬理試験-ウサギ子宮腺の発達に及ぼす影響(McPhail試験)-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)
28
薬理試験-ラットを用いたアンドロゲン作用の検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.3)
29
薬理試験-ラットを用いたグルココルチコイド作用の検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.3)
30
薬理試験-ラットを用いたミネラルコルチコイド作用の検討-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.3)
31
臨床薬理試験-健康成人女性におけるホルモン動態試験-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.6.5)
32
臨床薬理試験-子宮内膜症患者におけるホルモン動態試験-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.7.2)
33
大須賀 穣 他:薬理と治療. 2017;45(6):907-920
34
薬理試験-ヒト子宮内膜間質細胞の増殖に及ぼす影響-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)
35
Irahara, M. et al.:Reprod. Med. Biol. 2007;6(4):223-228
36
薬理試験-ラット子宮内膜自家移植モデルにおける有効性-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)
37
薬理試験-ウサギ子宮内膜自家移植モデルにおける有効性-(ディナゲスト錠:2007年10月19日承認、申請資料概要 2.6.2.2)