1
社内資料(日本人健康成人被験者における反復投与試験,2004)
2
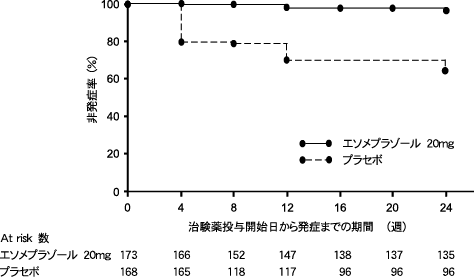
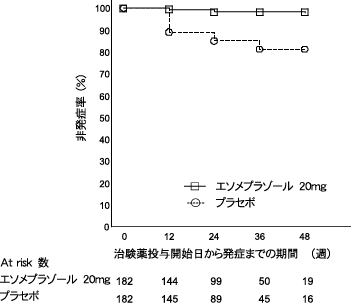
社内資料(日本人小児患者における第I/III相試験, 2016)
3
Äbelö, A., et al.:Drug Metab. Dispos. 2000, 28(8), 966-972
4
Andersson, T., et al.:Clin. Pharmacokinet. 2001, 40(6), 411-426
5
Hasselgren, G., et al.:Clin. Pharmacokinet. 2001, 40(2), 145-150
6
Sjövall, H., et al.:Eur. J. Gastroenterol. Hepatol. 2002, 14(5), 491-496
7
Li, XQ., et al.:Drug Metab. Dispos. 2004, 32(8), 821-827
8
社内資料(in vitro代謝酵素阻害,1998)
9
Andersson, T., et al.:Clin. Pharmacokinet. 2001, 40(7), 523-537
10
Hassan-Alin, M., et al.:Clin. Drug Investig. 2005, 25(11), 731-740
11
八木道夫:臨床医薬. 2011, 27(10), 747-756
12
Niazi, M., et al.:Int. J. Clin. Pharmacol. Ther. 2009, 47(9), 564-569
13
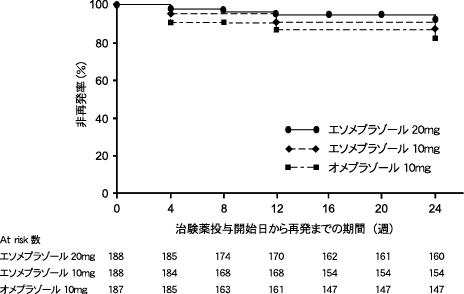
木下芳一 他:日消誌. 2013, 110(2), 234-242
14
木下芳一 他:日消誌. 2013, 110(8), 1428-1438
15
Sugano, K., et al.:Aliment. Pharmacol. Ther. 2012, 36(2), 115-125
16
Sugano, K., et al.:BMC Gastroenterology. 2013, 13:54
17
Sugano, K., et al.:Gut. 2014, 63(7), 1061-1068
18
長嶋浩貴 他:臨床医薬. 2011, 27(10), 735-746
19
社内資料(ウサギH+, K+-ATPaseに対する作用, 1988)
20
社内資料(単離ウサギ胃底腺における作用, 1997)
21
社内資料(胃瘻ラットにおける作用, 2002)
22
社内資料(Heidenhain Pouchイヌにおける作用, 2002)




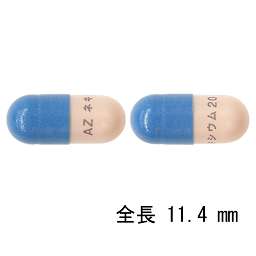
 5号カプセル
5号カプセル