1
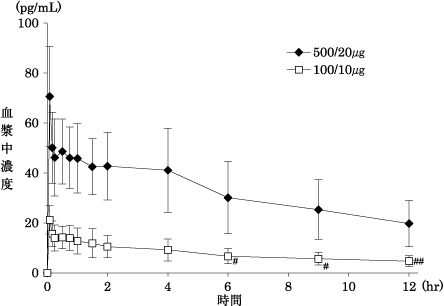
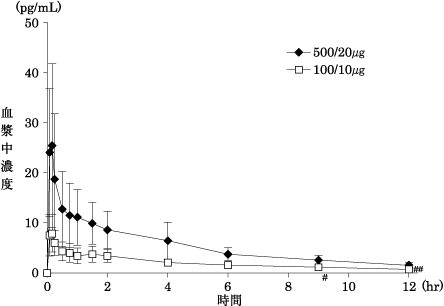
社内資料 :フルティフォームの第Ⅰ相臨床薬理試験(2013年9月20日承認、CTD2.7.6.2.1)
2
Daniel, M.J. et al. :基礎と臨床. 1992 ;26(6) :2011-2030
3
Cheer, S.M. et al. :Am. J. Respir. Med. 2002 ;1(4) :285-300
4
Pearce, R.E. et al. :Drug Metab. Dispos. 2006 ;34 :1035-1040
5
Harding, S.M. :Respir. Med. 1990 ;84 :25-29
6
Rosenborg, J. et al. :Drug Metab. Dispos. 1999 ;27(10) :1104-1116
7
大田健, 他. :アレルギー・免疫. 2013 ;20 :1671-1685
8
東田有智, 他. :アレルギー・免疫. 2013 ;20 :1686-1704
9
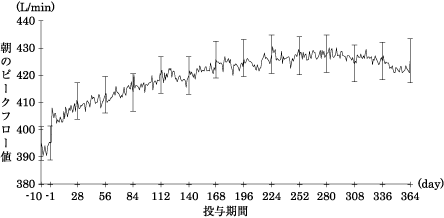
社内資料 :KRP-108第Ⅲ相比較試験-小児気管支喘息患者を対象としたKRP-108の非盲検、実薬対照、クロスオーバー比較試験-(2020年6月29日承認、CTD2.5.4.3.1)
10
社内資料 :KRP-108第Ⅲ相長期試験-小児気管支喘息患者を対象としたKRP-108の非盲検、非対照、長期投与試験-(2020年6月29日承認、CTD2.5.4.5.1)
11
Johnson, M. et al. :J. Allergy Clin. Immunol. 1998 ;101 :S434-S439
12
Valotis, A. et al. :Respir. Res. 2007 ;8 :54
13
Johnson, M. et al. :Int. Arch. Allergy Immunol. 1995 ;107 :439-440
14
Lawrence, T.E. et al. :J. Pharmacol. Exp. Ther. 1998 ;284 :222-227
15
Baker, J.G. :Br. J. Pharmacol. 2010 ;160 :1048-1061
16
Ida, H. :Arzneim. Forsch. 1976 ;26 :1337-1340
17
Sugiyama, H. et al. :J. Allergy Clin. Immunol. 1992 ;89 :858-866
18
Kaur, M. et al. :Mol. Pharamacol. 2008 ;73 :203-214