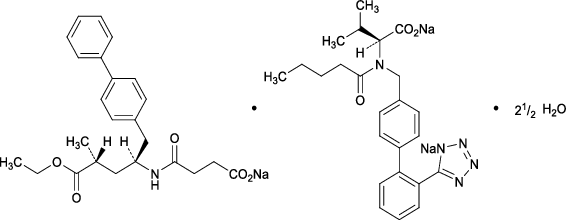
1
阿部真也ほか:周産期医学. 2017;47:1353-1355[20230027]
2
齊藤大祐ほか:鹿児島産科婦人科学会雑誌. 2021;29:49-54[20230028]
3
Sheps, S.G. et al.:Arch. Intern. Med. 1997;157(21):2413-2446[20003680]
4
Briggs, G.G. et al.:Ann. Pharmacother. 2001;35(7-8):859-861[20022566]
5
Akahori M, et al.:Eur J Drug Metab Pharmacokinet. 2017;42(3):407-416[20200233]
6
社内資料:小児の薬物動態(2024年2月9日承認、CTD2.7.2.2.2.1)[20230143]
7
社内資料:メトホルミンとの薬物間相互作用(2020年6月29日承認、CTD2.7.2.2.2.2)[20210076]
8
Ayalasomayajula S, et al.:Clin Pharmacokinet. 2017;56(12):1461-1478[20200234]
9
社内資料:健康成人の尿中濃度(2020年6月29日承認、CTD2.7.2.3.1.4)[20200235]
10
Ayalasomayajula S, et al.:Eur J Drug Metab Pharmacokinet. 2017;42(2):309-318[20200236]
11
社内資料:バイオアベイラビリティ試験(VAL489A1102試験)[20130476]
12
社内資料:バイオアベイラビリティ試験(VNP489A2106試験)[20200252]
13
社内資料:海外第Ⅲ相試験(2020年6月29日承認、CTD2.7.6.4.1.2)[20200237]
14
社内資料:国内第Ⅲ相試験(2020年6月29日承認、CTD2.7.6.4.1.1)[20200238]
15
社内資料:国際共同第Ⅱ/Ⅲ相試験(2024年2月9日承認、CTD2.7.6.4.1.1)[20230144]
16
Kleinman ME, et al.:Circulation 2010;122(18 Suppl 3):S876-908[20230148]
17
社内資料:国内第Ⅲ相試験(2021年9月27日承認、CTD2.7.6.4.1.4)[20210047]
18
社内資料:ラット血漿中ANP濃度に対する作用(2020年6月29日承認、CTD2.6.2.2.3.3)[20200239]
19
社内資料:低ナトリウム食飼育イヌの血漿中cGMP及びアルドステロンに対する作用(2020年6月29日承認、CTD2.6.2.2.6.2)[20200240]
20
社内資料:ラットのANP誘発尿中ナトリウム排泄に対する作用(2020年6月29日承認、CTD2.6.2.2.4.2)[20200241]
21
Ksander GM, et al.:J. Med. Chem. 1995;38(10):1689-1700[20200242]
22
von Lueder TG, et al.:Circ. Heart Fail. 2013;6(3):594-605[20200243]
23
社内資料:ダブルトランスジェニックラットにおける降圧作用(2020年6月29日承認、CTD2.6.2.2.5.7)[20200244]
24
社内資料:高血圧自然発症ラットにおける降圧作用(2020年6月29日承認、CTD2.6.2.2.5.7)[20200245]
25
社内資料:Dahl食塩感受性ラットにおける降圧作用(2020年6月29日承認、CTD2.6.2.2.5.7)[20200246]








 L
L