1
Rai A,et al.:Am J Respir Crit Care Med.2016;193:A1890
2
Jansson PS,et al.:J Emerg Med.2018;55:836-840
3
Vadas P.Am J Emerg Med.2020;38:1299.e1-2
4
Kane SP,et al.:Perfusion.2018;33:320-322
5
Pottegard,A.et al.:J.Intern.Med.2017;282(4):322-331
6
Pedersen,S.A.et al.:J.Am.Acad.Dermatol.2018;78(4):673-681
7
Beerman,B.et al.:Clin.Pharmacol.Ther.1976;19(5)Part1:531-537
8
松木俊二ほか:新薬と臨牀.2012;61(3):617-624
9
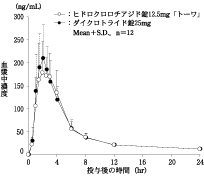
社内資料:生物学的同等性試験(錠25mg)
10
第十七改正日本薬局方解説書.2016;C-4141-4145
11
Kohler,C.et al.:Eur.J.Pharmacol.1977;42:161-169
12
飯村攻ほか:綜合臨牀.1960;9(10):1861-1869
13
Juchems,R.et al.:Med.Klin.1967;62(15):600-604
14
Shah,S.et al.:Amer.Heart J.1978;95(5):611-618
15
Davila,D.et al.:Pharmacology.1981;22:108-112








 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379

