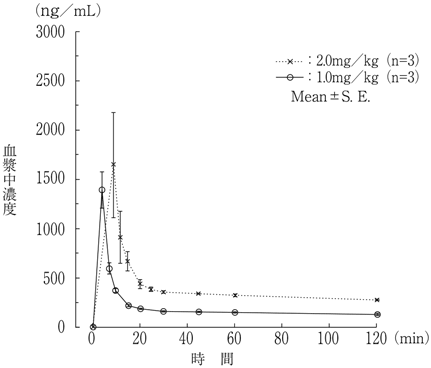
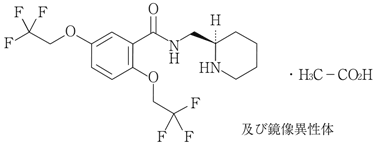
1
Echt D. S. et al.:N. Engl. J. Med., 1991;324(12):781-788 [TMB-0036]
2
新 博次ら:臨床薬理, 1996;27(4):713-723 [TMB-0292]
3
McQuinn R. L. et al.:Drug Metab. Dispos., 1984;12(4):414-420 [TMB-0001]
4
加藤和三ら:臨牀と研究, 1995;72(2):459-477 [TMB-0296]
5
加藤和三ら:臨牀と研究, 1995;72(2):478-490 [TMB-0297]
6
加藤和三ら:臨牀と研究, 1995;72(2):491-503 [TMB-0298]
7
Kvam D. C. et al.:Am. J. Cardiol., 1984;53(5):22B-25B [TMB-0004]
8
Akiyama K. et al.:Jpn. Heart J., 1989;30(4):487-495 [TMB-0003]
9
加藤浩嗣ら:薬理と治療, 1997;25(1):131-139 [TMB-0252]
10
加藤浩嗣ら:薬理と治療, 1997;25(1):121-130 [TMB-0251]
11
Ikeda N. et al.:J. Am. Coll. Cardiol., 1985;5(2):303-310 [TMB-0002]
12
高仲知永ら:環境医学研究所年報, 1987;(38):204-208 [TMB-0005]
13
澤田光平:薬理と治療, 1997;25(1):141-149 [TMB-0253]
14
Cambell T. J.: Br. J. Pharmacol., 1983;80(1):33-40 [TMB-0142]
15
加藤浩嗣ら:基礎と臨床, 1991;25(15):4785-4794 [TMB-0096]