1
Kristensen, J. H., et al.:Br. J. Clin. Pharmacol. 2007;63(3):322-327
2
Ruigt, G. S. F., et al.:Eur. J. Clin. Pharmacol. 1990;38(6):551-554
3
薬理試験(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.6.2.2)
4
大谷義夫, 他:基礎と臨床. 1990;24(10):5365-5377
5
単回投与試験(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.7.2.2)
6
反復投与試験(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.7.2.2)
7
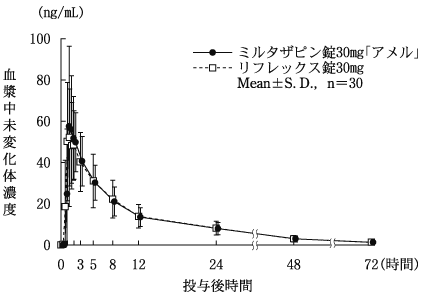
社内資料:生物学的同等性試験[錠30mg]
8
食事の影響試験(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.7.1.2)
9
血漿タンパクとの結合(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.7.2.2)
10
Dahl, M.-L., et al.:Clin. Drug Invest. 1997;13(1):37-46
11
マスバランス試験(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.7.2.2)
12
Bengtsson, F., et al.:Hum. Psychopharmacol. Clin. Exp. 1998;13:357-365
13
肝機能低下の影響(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.7.2.2)
14
Timmer, C. J., et al.:Human psychopharmacology. 1996;11:497-509
15
薬物相互作用(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.7.2.2)
16
Spaans, E., et al.:Eur. J. Clin. Pharmacol. 2002;58:423-429
17
Sitsen, J. M. A., et al.:J. Psychopharmacol. 2000;14(2):172-176
18
Loonen, A. J. M., et al.:Eur. Neuropsychopharmacol. 1999;10:51-57
19
社内資料:生物学的同等性試験(溶出挙動比較)
20
木下利彦:臨床精神薬理. 2009;12(2):289-306
21
プラセボ対照用量検討試験(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.7.6.28)
22
村崎光邦, 他:臨床精神薬理. 2010;13(2):339-355
23
木下利彦:臨床精神薬理. 2009;12(3):503-520
24
長期投与試験(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.7.6.57)
25
本剤の用法・用量について(レメロン錠・リフレックス錠:2009年7月7日承認、審査報告書)
26
Haddjeri, N., et al.:J. Pharmacol. Exp. Ther. 1996;277(2):861-871
27
ミルタザピンの薬理作用上の特徴と抗うつ作用(レメロン錠・リフレックス錠:2009年7月7日承認、申請資料概要 2.6.2.6)
28
Andrews, J. S., et al.:Drug Dev. Res. 1994;32(2):58-66
29
O’Connor, W. T., et al.:Neuropharmacology. 1986;25(3):267-270
30
Nowakowska, E., et al.:Pol. J. Pharmacol. 1999;51(6):463-469






 0120-041-189
0120-041-189

