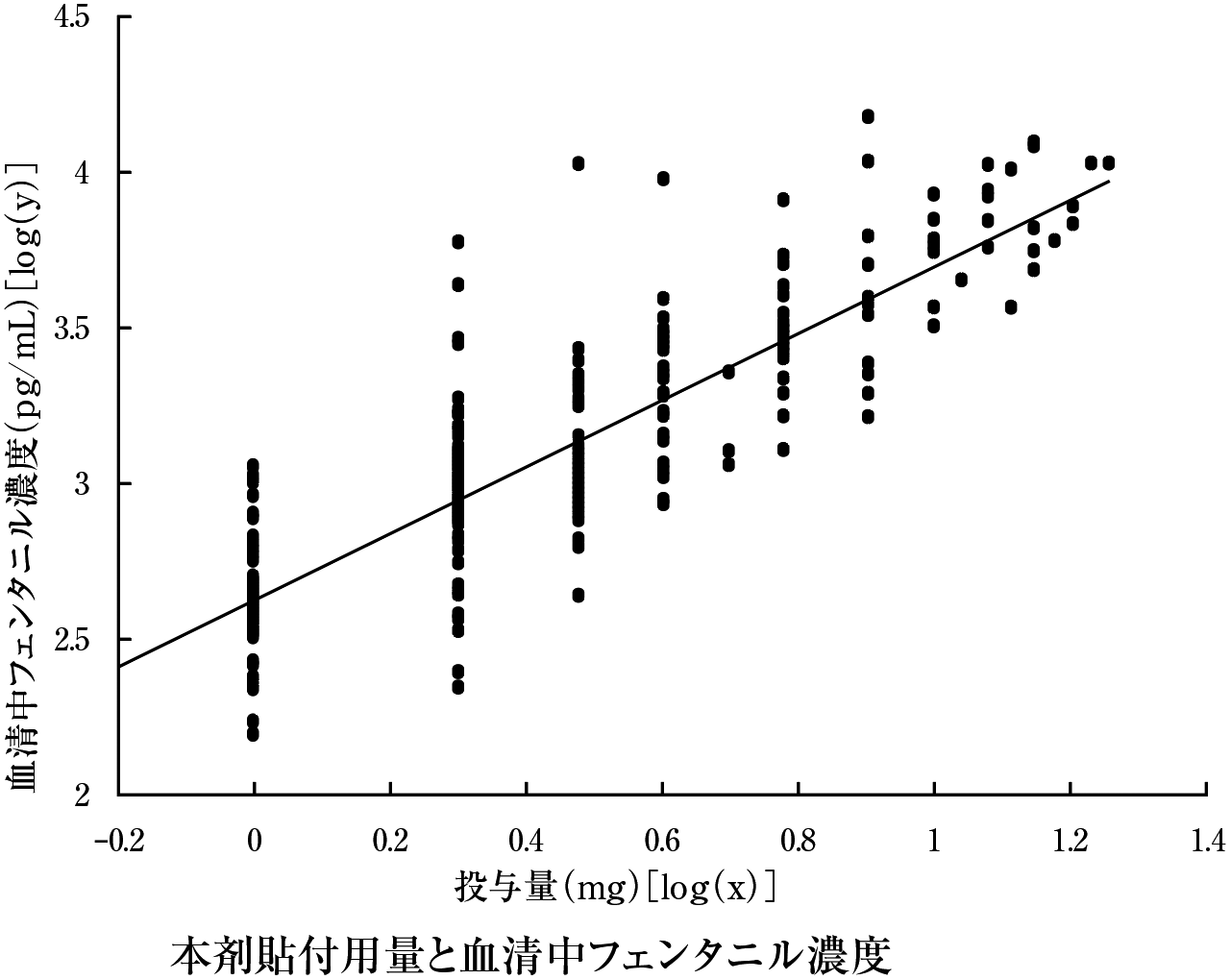
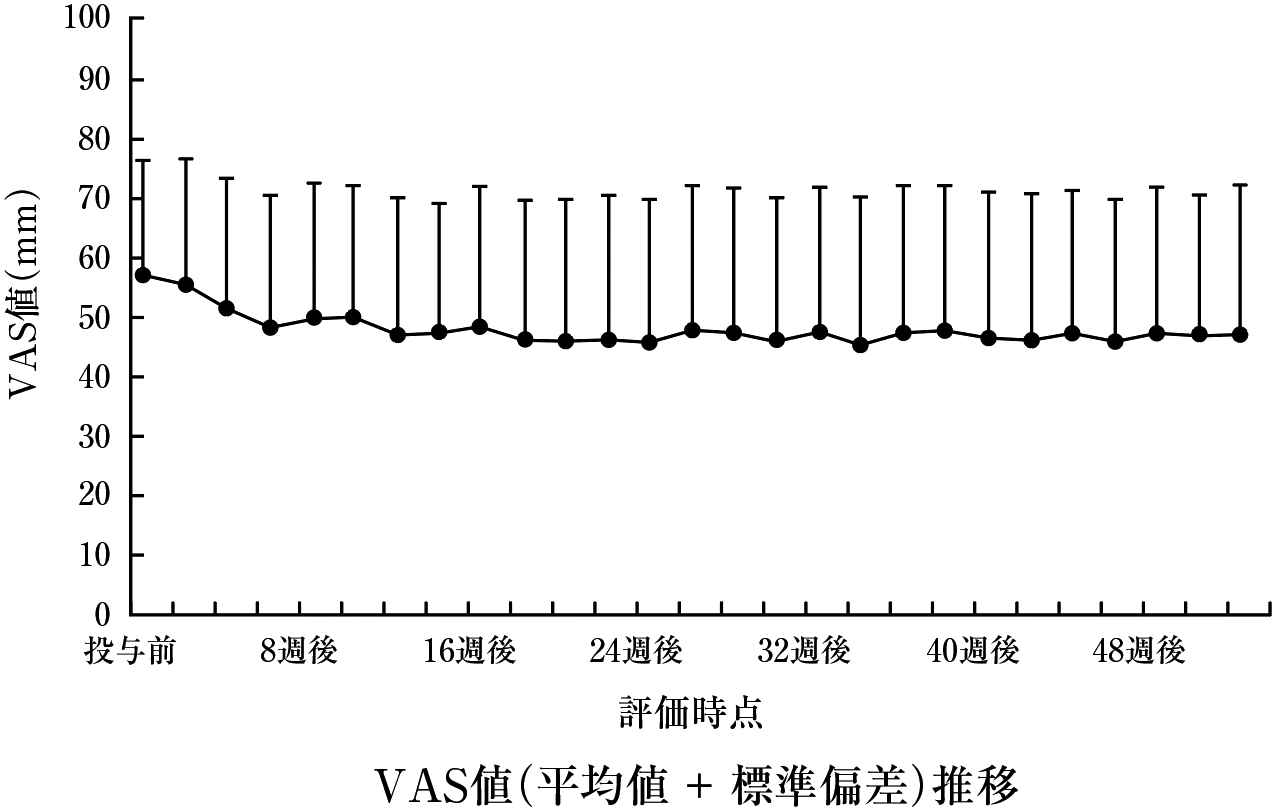
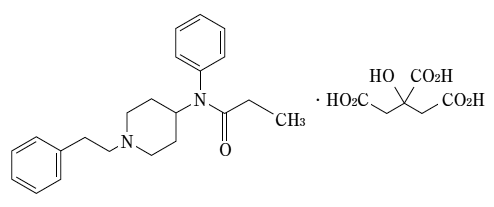
1
久光製薬社内資料. ラットを用いた胚・胎児発生に関する試験(2010年4月16日承認、CTD2.6.6.6).
2
Leuschen MP, et al.: Clin Pharm 1990; 9(5): 336-7.
3
久光製薬社内資料. 小児がん疼痛患者を対象とした薬物動態試験(2021年8月25日承認、CTD2.7.6.1).
4
久光製薬社内資料. 特別な患者集団及び状況下における安全性(2021年8月25日承認、CTD2.7.4.5).
5
Bentley JB, et al.: Anesth Analg 1982; 61(12): 968-71.
6
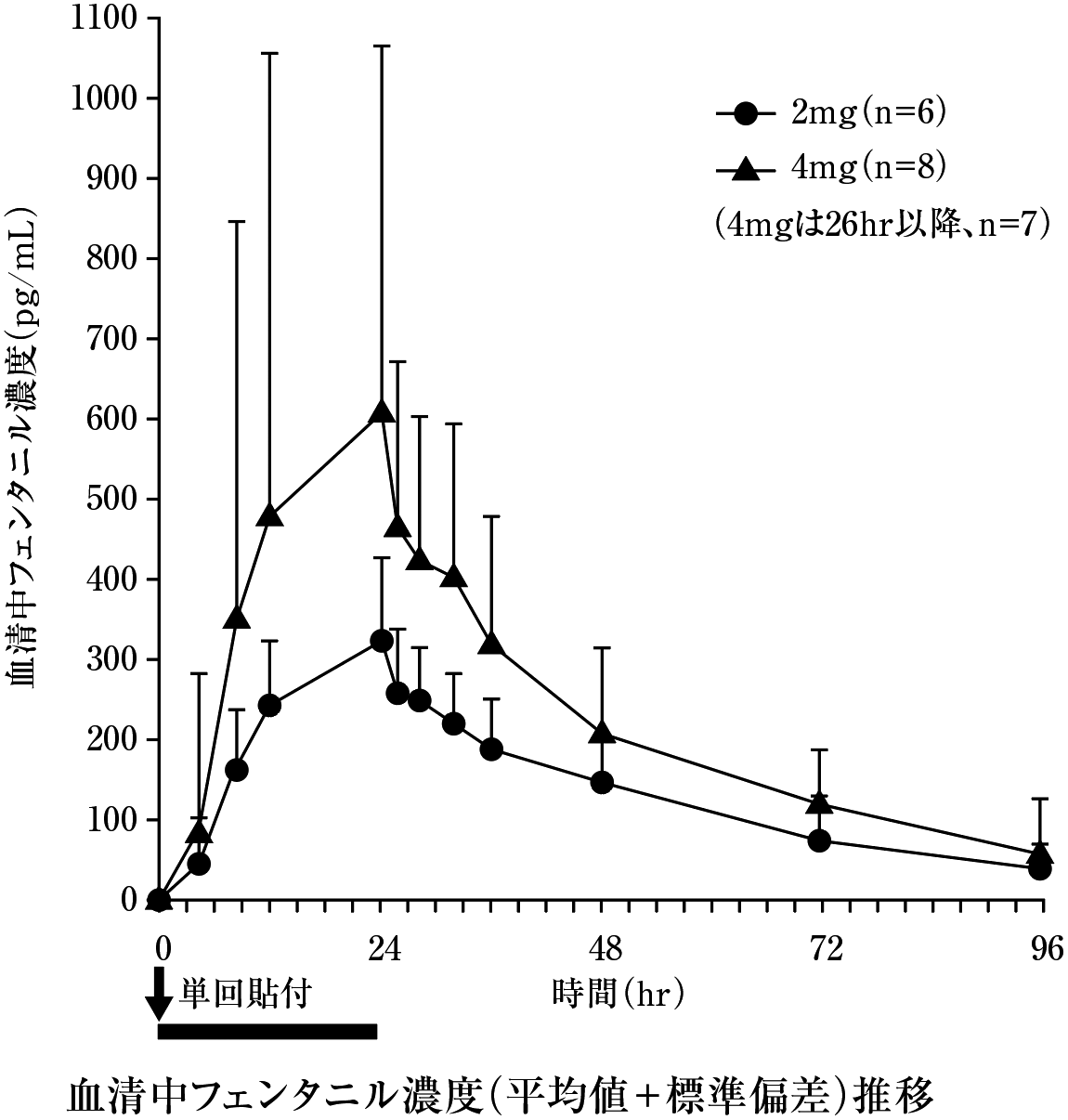
久光製薬社内資料. 単回貼付試験(2010年4月16日承認、CTD2.7.2.2).
7
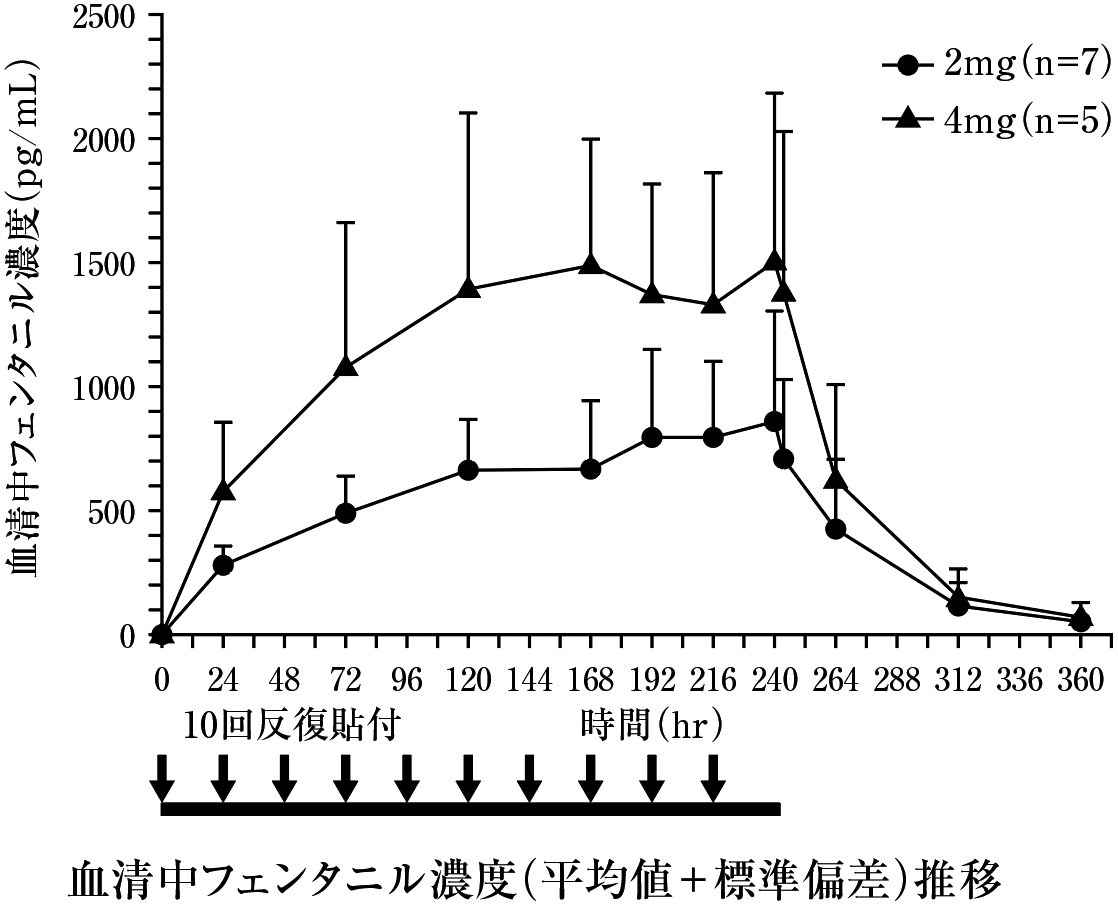
久光製薬社内資料. 反復貼付試験(2010年4月16日承認、CTD2.7.2.2).
8
久光製薬社内資料. モルヒネ製剤からの切り替え貼付試験(2010年4月16日承認、CTD2.7.2.3).
9
久光製薬社内資料. 慢性疼痛に対する長期投与試験(2014年6月20日承認、CTD2.7.2.2、2.7.6.2).
10
久光製薬社内資料. ラットにおける薬物動態試験(2010年4月16日承認、CTD2.6.4.4).
11
大塚宏之 ほか: 薬理と治療 2001; 29(11): 865-76.
12
Feierman DE et al.: Drug Metab Dispos 1996; 24(9): 932-9.
13
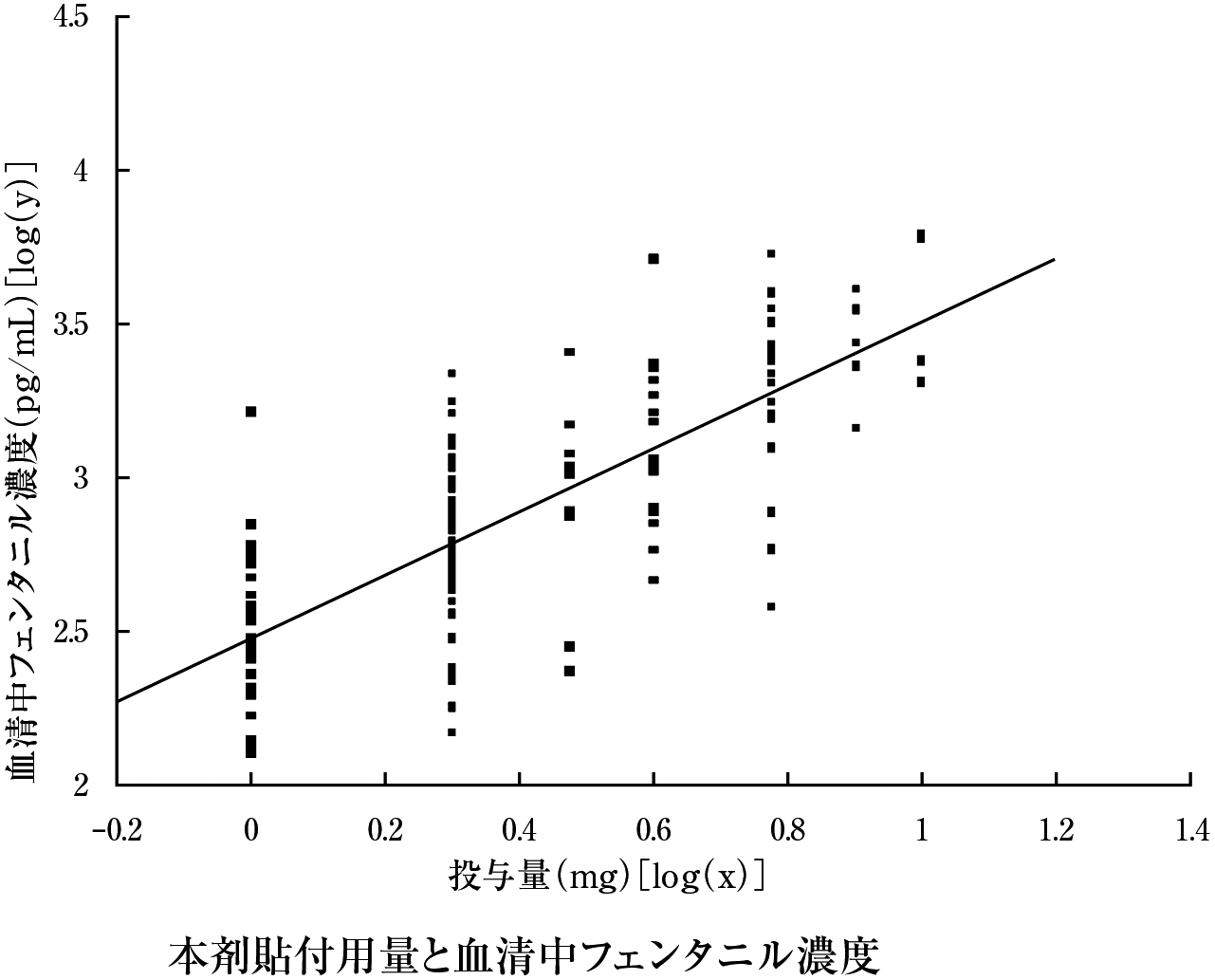
久光製薬社内資料. 全試験を通しての結果の比較と解析(2021年8月25日承認、CTD2.7.2.3).
14
久光製薬社内資料. モルヒネ製剤又はオキシコドン経口剤からの切り替え貼付試験(2010年4月16日承認、CTD2.7.6.8).
15
久光製薬社内資料. フェンタニル経皮吸収型製剤からの切り替え貼付試験(2010年4月16日承認、CTD2.7.6.6).
16
久光製薬社内資料. オピオイド鎮痛剤未使用のがん疼痛患者に対する試験(2020年6月29日承認、CTD2.7.6.1).
17
久光製薬社内資料. 慢性疼痛に対する第III相臨床試験(2014年6月20日承認、CTD2.7.6.1).
18
Maguire P, et al.: Eur J Pharmacol 1992; 213(2): 219-25.
19
Raynor K, et al.: Mol Pharmacol 1994; 45(2): 330-4.
20
Brunton LL, et al.: グッドマン・ギルマン薬理書 第11版. 廣川書店; 2007. p.669-728.
21
久光製薬社内資料. ウサギ歯髄刺激モデルを用いた鎮痛作用(2010年4月16日承認、CTD2.6.2.2).