持続性癌疼痛治療剤
1錠 399円
| 色・剤形 | 白色のフィルムコーティング錠 |
|---|---|
| 外形 表面 |  |
| 裏面 |  |
| 側面 |  |
| 大きさ 長径(mm) | 17 |
| 短径(mm) | 7 |
| 厚さ(mm) | 5 |
| 重量(mg) | 412 |
| 識別記号 | OMJ 25 |
| 色・剤形 | 白色のフィルムコーティング錠 |
|---|---|
| 外形 表面 |  |
| 裏面 |  |
| 側面 |  |
| 大きさ 長径(mm) | 17 |
| 短径(mm) | 7 |
| 厚さ(mm) | 5 |
| 重量(mg) | 412 |
| 識別記号 | OMJ 50 |
| 色・剤形 | うすい青色のフィルムコーティング錠 |
|---|---|
| 外形 表面 |  |
| 裏面 |  |
| 側面 |  |
| 大きさ 長径(mm) | 17 |
| 短径(mm) | 7 |
| 厚さ(mm) | 5 |
| 重量(mg) | 412 |
| 識別記号 | OMJ 100 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| **,*MAO阻害剤(セレギリン塩酸塩(エフピー)、ラサギリンメシル酸塩(アジレクト)、サフィナミドメシル酸塩(エクフィナ)) | 心血管系副作用の増強やセロトニン症候群等の重篤な副作用発現のおそれがある。MAO阻害剤を投与中の患者又は投与中止後14日以内の患者には投与しないこと。 | 相加的に作用が増強されると考えられる。 |
| **ナルメフェン塩酸塩(セリンクロ) | 離脱症状を起こすおそれがある。また、鎮痛作用が減弱するおそれがある。 ナルメフェン塩酸塩を投与中の患者又は投与中止後1週間以内の患者には投与しないこと。[「禁忌」の項参照] | μオピオイド受容体への競合的阻害による。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| オピオイド鎮痛剤 中枢神経抑制剤(フェノチアジン誘導体、バルビツール酸誘導体等) アルコール | 呼吸抑制、低血圧及び顕著な鎮静又は昏睡が起こることがある。 減量するなど慎重に投与すること。 | 中枢神経抑制作用が相加的に増強される。 |
| 三環系抗うつ剤 セロトニン作用薬(選択的セロトニン再取り込み阻害剤(SSRI)、セロトニン・ノルアドレナリン再取り込み阻害剤(SNRI)等) | セロトニン症候群(錯乱、激越、発熱、発汗、運動失調、反射亢進、ミオクローヌス、下痢等)があらわれるおそれがある。 | 相加的に作用が増強され、また、中枢神経のセロトニンが蓄積すると考えられる。 |
| ブプレノルフィン ペンタゾシン等 | 本剤の鎮痛作用を減弱させることがある。また、退薬症候を起こすことがある。 | これらの薬剤は本剤が作用するμ受容体の部分アゴニストである。 |
| プロベネシド1) | 本剤の血中濃度が上昇することがある。 | 本剤の代謝を阻害する可能性がある。 |
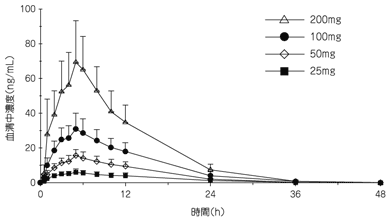
| 25mg | 50mg | 100mg | 200mga) | |
| n | 23 | 23 | 22 | 21 |
| Cmax(ng/mL) | 6.61(1.67) | 16.0(3.59) | 32.4(7.95) | 72.0(22.3) |
| AUC∞(ng・h/mL) | 100(26.6)c) | 218(44.6) | 428(84.4) | 877(213) |
| tmaxb)(h) | 5.0(2.0-12.0) | 5.0(4.0-8.0) | 5.0(2.0-12.0) | 5.0(2.0-6.0) |
| t1/2(h) | 6.1(1.7)c) | 5.2(1.0) | 5.0(1.1) | 4.7(0.7) |
| 肝機能 | 正常 | 軽度障害a) | 中等度障害a) |
| n | 10 | 10 | 10 |
| Cmax(ng/mL) | 50.9(23.3) | 66.9(22.4) | 132(58.6) |
| AUC∞(ng・h/mL) | 257(77.3) | 477(266) | 1171(516) |
| tmaxb)(h) | 1.5(1.0-3.0) | 1.5(0.5-2.0) | 1.3(0.5-6.0) |
| t1/2(h) | 4.3(0.6) | 5.1(0.9) | 6.2(1.5) |
| 腎機能 | 正常 | 軽度障害a) | 中等度障害a) | 重度障害a) |
| n | 9 | 10 | 10 | 10 |
| タペンタドール | ||||
| Cmax(ng/mL) | 58.8(20.4) | 65.0(20.7) | 56.5(14.1) | 59.2(31.8) |
| AUC∞(ng・h/mL) | 301(53.0) | 364(120) | 353(122) | 354(189) |
| tmaxb)(h) | 1.0(1.0-1.5) | 1.5(1.0-4.0) | 1.5(1.0-4.0) | 1.0(1.0-4.0) |
| t1/2(h) | 4.7(0.5) | 5.4(2.0) | 5.1(0.7) | 8.2(2.9) |
| CL/F(mL/min) | 4579(919) | 4025(1308) | 4432(2243) | 4447(1603) |
| CLR(mL/min) | 105(32.5) | 78.6(57.0) | 60.7(37.3) | 29.3(21.2) |
| グルクロン酸抱合体 | ||||
| Cmax(ng/mL) | 2428(624) | 3134(1094) | 3180(875) | 3472(734) |
| AUC∞(ng・h/mL) | 13916(3123) | 21258(6486) | 36191(11874) | 84942(52258) |
| tmaxb)(h) | 1.5(1.0-2.0) | 1.5(1.0-2.0) | 1.5(1.0-6.0) | 3.5(1.5-9.0) |
| t1/2(h) | 4.3(0.2) | 5.1(1.6) | 6.7(2.0) | 14.2(8.0) |
| CLR(mL/min) | 78.8(32.0) | 50.0(26.7) | 31.3(14.2) | 12.6(7.47) |
| 本剤群 | オキシコドン群 | |
| 例数 | 126 | 139 |
| 平均値(標準偏差) | -2.69(2.223) | -2.57(2.027) |
| 最小二乗平均値の差注)(標準誤差) | -0.06(0.226) | -0.06(0.226) |
| 95%信頼区間 | (-0.506;0.383) | (-0.506;0.383) |
| 例数 | 50 |
| 疼痛コントロールが達成された被験者数 | 42(84.0%) |
| 95%信頼区間 | (70.89;92.83) |